
对于反应:CaCO3+2HCl===CaCl2+H2O+CO2↑,下列说法正确的是( )
A.用HCl和CaCl2表示的反应速率数据不同,但所表示的意义相同
B.不能用CaCO3的浓度变化来表示反应速率,但可用水来表示
C.用H2O和CO2表示的化学反应速率相同
D.可以用CaCl2浓度的减小表示其反应速率
科目:高中化学 来源: 题型:
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为 。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) == NH2CO2 NH4(s) △H= —l59.5 kJ·mol-1
②NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(1) == H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______,电子数为________。
(2)硅主要以硅酸盐、________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/(kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是______________________________________________。
(6)在硅酸盐中,SiO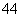 四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图2-1-1表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )。
A. ①④ B. ③④ C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温、恒容的密闭容器中进行反应A(g)==B(g)+C(g),若反应物的浓度由2 mol·L-1降到0.8 mol·L-1 需20 s,那么反应物由0.8 mol·L-1降到0.2 mol·L-1所需反应的时间为( )
A.10 s B.小于10 s
C.大于10 s D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2
表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为(  )
)
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2的分解反应为COCl2(g)===Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min 的COCl2浓度变化曲线未示出):
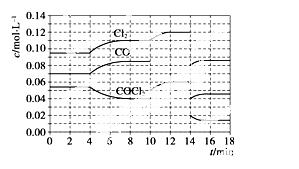
①计算反应在第8 min时的平衡常数K=____________;
②比较第2 min反应温 度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
度T(2)与第8 min反应温度T(8)的高低:T(2)________T(8)(填“<”、“>”或“=”);
③若12 min时反应于 温度T(8)下重新达到平衡,则此时c(COCl2)=________
温度T(8)下重新达到平衡,则此时c(COCl2)=________
mol·L-1;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示] 的大小____________________________;
的大小____________________________;
⑤比较反应物COCl2在5~6 min和 15~16 min时平均反应速率的大小:v(5~6)________v(15~16)(填“<”、“>”或“=”),原因是______________________。
15~16 min时平均反应速率的大小:v(5~6)________v(15~16)(填“<”、“>”或“=”),原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%-103.0%)的主要流程如下:
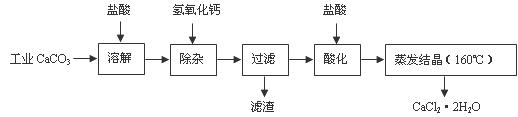
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0-8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①
;② 。
(3)测定样品中Cl- 含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①计算上述样品中CaCl2·2H2O的质量分数为 。
②若用上述办法测定的样品中CaCl2·2H2O的质量分数有时超过100.0%(测定过程中产生的误差可忽略),其可能原因有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com