
【题目】Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
(1)甲同学取一束细铜丝用砂纸打磨后在酒精灯上加热至红热,再伸到Cl2的集气瓶中.你认为甲同学在实验中应该观察到的现象是 .
(2)乙同学为验证Fe在冷的浓HNO3中发生钝化但能和热的浓HNO3反应,设计了如图1、2所示的实验,请你指出其中的两处错误:、;纠正上述错误后,请你从绿色化学的角度出发,对图2装置提出改进建议,使装置既能控制反应的进行,又能减少氮氧化物的排放: . 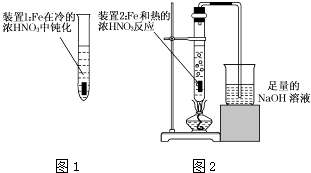
(3)丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片逐渐溶解,反应一段时间后不再溶解(Cu有剩余). ①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应.他依据的反应现象是 .
②丁同学认为丙同学的结论不完全正确.他的理由是 .
(4)请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+ . 说明具体的操作和实验现象 .
【答案】
(1)Cu能在Cl2中燃烧,产生棕黄色的烟
(2)两只试管中的液体均超过试管容积的 ![]() ;加热液体的试管不与桌面成45°角向上倾斜;将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一端深入硝酸中,另一端伸出橡胶塞
;加热液体的试管不与桌面成45°角向上倾斜;将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一端深入硝酸中,另一端伸出橡胶塞
(3)试管上部出现红棕色气体;Fe和硝酸反应后的溶液中可能有HNO3 , 但也一定有Fe3+ , Fe3+也能和Cu反应而使Cu片溶解
(4)取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+
【解析】解:(1)铜在氧气中不燃烧,在氯气中能燃烧产生棕黄色烟, 所以答案是:Cu能在Cl2中燃烧,产生棕黄色的烟;(2)加热液体时,试管内的液体超过试管的三分之一,超过三分之一时,加热过程中容易产生暴沸,造成安全事故;加热液体的试管不与桌面成45°角向上倾斜,不能竖直向上;改进后的铜丝容易抽拉,即容易控制反应的进行,从而减少氮氧化物的排放,将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一端深入硝酸中,另一端伸出橡胶塞,既能控制反应的进行又能减少氮氧化物的排放;所以答案是:两只试管中的液体均超过试管容积的 ![]() ;加热液体的试管不与桌面成45°角向上倾斜;将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一端深入硝酸中,另一端伸出橡胶塞;(3)①二氧化氮能和水反应生成硝酸和一氧化氮,当溶液中硝酸过量时,抑制二氧化氮的溶解,所以可看到气体呈红棕色,所以答案是:试管上部出现红棕色气体;②硝酸过量时,铁和硝酸反应生成三价铁,三价铁和铜能反应生成二价铁离子和铜离子,从而使铜片溶解,发生反应为2Fe3++Cu=Cu2++2Fe2+ , 所以答案是:Fe和硝酸反应后的溶液中可能有HNO3 , 但也一定有Fe3+ , Fe3+也能和Cu反应而使Cu片溶解;(4)取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+ , 所以答案是:取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+ . 所以答案是:2Fe3++Cu=Cu2++2Fe2+ .
;加热液体的试管不与桌面成45°角向上倾斜;将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一端深入硝酸中,另一端伸出橡胶塞;(3)①二氧化氮能和水反应生成硝酸和一氧化氮,当溶液中硝酸过量时,抑制二氧化氮的溶解,所以可看到气体呈红棕色,所以答案是:试管上部出现红棕色气体;②硝酸过量时,铁和硝酸反应生成三价铁,三价铁和铜能反应生成二价铁离子和铜离子,从而使铜片溶解,发生反应为2Fe3++Cu=Cu2++2Fe2+ , 所以答案是:Fe和硝酸反应后的溶液中可能有HNO3 , 但也一定有Fe3+ , Fe3+也能和Cu反应而使Cu片溶解;(4)取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+ , 所以答案是:取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+ . 所以答案是:2Fe3++Cu=Cu2++2Fe2+ .


科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 
A.常压下五种元素的单质中Z单质的沸点最高
B.X和W的常见单质的分子式分别为X2和W2
C.W的氢化物沸点比X的氢化物的沸点低
D.R最高氧化物水化物的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2 . 在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是( )
A.Cu与Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O反应中,
(1)氧化剂是__,氧化产物是__.
(2)写出该反应的离子方程式.__.
(3)若有219gHCl参加反应,产生Cl2的体积(标况下)为__ L,转移电子__ mol.
(4)Cl2有毒,多余的Cl2通常用氢氧化钠溶液吸收,反应的离子方程式为:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲和乙的某些性质如表所示:
物质 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 水中的溶解性 |
甲 | -98 | 37.5 | 0.93 | 可溶 |
乙 | -48 | 95 | 0.90 | 可溶 |
现有甲和乙的混合物,进行分离时,可采用的方法是( )
A.过滤B.蒸发C.蒸馏D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
D. 混合溶液中c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-![]() H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com