
【题目】I.已知:① NaHCO3(s)==Na+(ag)+HCO3-(aq) △H=+18.81kJ·mo1-1
②Na2CO3(s)==2Na+(aq)+CO32-(aq)△H=-16.44 k J· mol-1
③2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(1) △H=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热 NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________。
(2) NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2O![]() H2CO3+OH-,b.2HCO3-
H2CO3+OH-,b.2HCO3-![]() CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):
CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为___________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是___________。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c(mo1·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
请在图中作出 NaHCO3溶液pH随时间变化曲线______________

II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图

(1)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
(2)列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(3)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________。
【答案】2HCO3—(aq) == CO32—(aq)+CO2(g)+H2O(l) △H=+38.28kJmol—1,反应需要的能量比固体小 1.7×10—3 Na2CO3 
66.7 % 5 5.0×104 充入适量的乙烯
【解析】
根据图象信息判断化学平衡移动方向进而进一步推断和计算;根据气体分压计算平衡常数分析解答;根据三段式分析计算化学平衡中的各组分数据。
(1) 根据所给热化学方程式结合盖斯定律可得2HCO3—(aq) == CO32—(aq)+CO2(g)+H2O(l) △H=+38.28kJmol—1,所以加热 NaHCO3溶液需要的能量比固体小;
故答案为:2HCO3—(aq) == CO32—(aq)+CO2(g)+H2O(l) △H=+38.28kJmol—1,反应需要的能量比固体小;
(2) ①根据图象可知,25℃时,HCO3-的转化率为0.2%,即生成H2CO3的浓度为:0.10mol·L-1×0.2%=2×10-4mol/L,25℃时,反应b中HCO3—的转化率为3.0%,即生成CO2的浓度为:0.10mol·L-1×3.0%×![]() =1.5×10-3mol/L,所以25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为:2×10-4mol/L+1.5×10-3mol/L=1.7×10—3mol/L;
=1.5×10-3mol/L,所以25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为:2×10-4mol/L+1.5×10-3mol/L=1.7×10—3mol/L;
故答案为:1.7×10—3;
②加热蒸干NaHCO3溶液,NaHCO3受热分解生成Na2CO3、CO2、和水,所以最后得到的固体是Na2CO3;
故答案为:Na2CO3;
③根据已知条件,碳酸钠的起始pH应该为8.3,所以起点从8.3出发,由表格中碳酸钠的浓度是0.10mol/L时,pH为11.5,即4分钟时,碳酸钠溶液的pH为11.5,保温7分钟内,pH变化不大;
故答案为: ;
;
II.(1)根据方程式 2CH4(g)![]() C2H4(g)+2H2(g),假设达到平衡时,生成n(C2H4)为xmol,
C2H4(g)+2H2(g),假设达到平衡时,生成n(C2H4)为xmol,
起始(n) 0.3mol 0mol 0mol
反应 (n) 2xmol xmol 2xmol
平衡(n) (0.3-2x)mol xmol 2xmol,由于恒容密闭容器体积不变,所以达到平衡时,c(C2H4)=c(CH4),即n(C2H4)=n(CH4)=x=0.3-2x,计算得x=0.1mol,甲烷的转化率为:![]() =66.7%,从图象可知,温度升高,各气体的分压减小,即反应向逆反应方向移动,所以甲烷的物质的量增加,则T2>T,假设再次平衡时乙烯的物质的量是ymol,则根据方程式可知生成甲烷的物质的量是2ymol,因此0.1+2y=2×(0.1-y),解得y=0.025mol,这说明甲烷的物质的量增加了0. 1mol-0.025mol×2=0.05mol,所以时间t=
=66.7%,从图象可知,温度升高,各气体的分压减小,即反应向逆反应方向移动,所以甲烷的物质的量增加,则T2>T,假设再次平衡时乙烯的物质的量是ymol,则根据方程式可知生成甲烷的物质的量是2ymol,因此0.1+2y=2×(0.1-y),解得y=0.025mol,这说明甲烷的物质的量增加了0. 1mol-0.025mol×2=0.05mol,所以时间t=![]() =5s;
=5s;
故答案为:66.7%;5s;
(2)根据图象可知,平衡时甲烷、氢气、乙炔的平均分压分别是103、104、![]() ,所以
,所以
A点温度时的平衡常数为:K=![]() =5.0×104;
=5.0×104;
故答案为;5.0×104;
(3)根据方程式可知,增大乙烯的浓度可以增大甲烷的浓度,进而提高乙炔的转化率;
故答案为:充入适量的乙烯。


科目:高中化学 来源: 题型:
【题目】向20mL 0.5mol/L的氨水中逐滴加入等物质的量浓度的盐酸,测定混合溶液的温度变化如图所示.下列关于混合溶液的说法错误的是

A. 从a点到b点,混合溶液不可能存在:c(Cl-)=c(NH4+)
B. 由水电离的c(H+):b点>c点
C. NH3·H2O的电离程度:b点>a点
D. b点到c点,混合溶液中可能存在:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度的定容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡状态的是:
2AB(g)达到平衡状态的是:
A. 混合气体的密度不再改变
B. 容器内的总压强不随时间而变化
C. 单位时间内生成2n mol AB的同时,生成n mol的B2
D. A2、B2、AB的分子数之比为1:1:2时
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法错误的是

A. 原子序数由小到大的顺序是:W<Z<Y<X
B. Z的最高价氧化物对应的水化物一定为强酸
C. 化合物的沸点由高到低的顺序是:乙>甲>丙
D. Y与W、Z都能形成两种或两种以上的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 反应CaC2(s) + N2(g) = CaCN2(s) + C(s) 的![]() H<0
H<0
B. 海上石油钢铁钻井平台可用外加电流的阴极保护法以防腐
C. H2O2催化分解每产生1molO2,转移电子的数目为2×6.02×1023
D. 25℃时,加水稀释0.1mol·L-1NH4Cl,溶液中![]() 不断增大
不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg / LiFePO4电池的电池反应为xMg2++2LiFePO4![]() xMg+2Li1-xFePO4+2xLi+,其装置示意图如下:
xMg+2Li1-xFePO4+2xLi+,其装置示意图如下:

下列说法正确的是
A. 放电时,Li+被还原
B. 充电时,电能转变为化学能
C. 放电时,电路中每流过2mol电子,有1molMg2+迁移至正极区
D. 充电时,阳极上发生的电极反应为LiFePO4-xe-= Li1-xFePO4 + xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H(碘他拉酸)可用于CT检查、动静脉造影等,其一种合成路线如下:

(1)H中的含氧官能团名称为_____。
(2)F→G的反应类型为_____。
(3)E的分子式为C9H8N2O5,E→F发生还原反应,写出E的结构简式:_____。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_____。
①在酸性条件下能水解生成X、Y、Z三种有机物。
②X是一种氨基酸,Y能发生银镜反应,Z能与FeCl3溶液发生显色反应且分子中只有2种不同化学环境的氢。
(5)泛影酸丙酯( )是一种医学诊断剂,写出以
)是一种医学诊断剂,写出以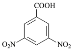 、CH3CH2CH2Cl和(CH3CO)2O为原料制备泛影酸丙酯的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________________。
、CH3CH2CH2Cl和(CH3CO)2O为原料制备泛影酸丙酯的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com