
分析 (1)根据KClO3与O2之间的关系式计算消耗的n(KClO3),根据K原子守恒计算生成n(KCl);
(2)二氧化锰在该反应中作催化剂,在反应前后其质量不变;
(3)根据质量守恒定律计算剩余固体总质量.
解答 解:(1)该反应方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,根据KClO3与O2之间的关系式计算消耗的n(KClO3)=$\frac{n({O}_{2})}{3}×2$=$\frac{\frac{6.72L}{22.4L/mol}}{3}×2$=0.2mol,根据K原子守恒计算生成n(KCl)=n(KClO3)=0.2mol,
答:消耗氯酸钾的物质的量是0.2mol,生成氯化钾的物质的量是0.2mol;
(2)二氧化锰在该反应中作催化剂,在反应前后其质量不变,其物质的量不变,则n(MnO2)=$\frac{0.87g}{87g/mol}$=0.01mol,
答:二氧化锰的物质的量是0.01mol;
(3)根据质量守恒定律知,反应前后物质总质量不变,则剩余固体总质量=50g+0.87g-0.87g-$\frac{6.72L}{22.4L/mol}×32g/mol$=40.4g,
答:剩余固体质量为40.4g.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式、质量守恒定律是解本题关键,注意催化剂特点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | M的气态氢化物比N的气态氢化物稳定 | |
| B. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| C. | M与X形成的化合物对应的水化物一定是强酸 | |
| D. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
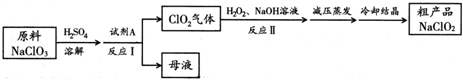
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液、胶体和浊液这三种分散系的根本区别是分散质粒子直径的大小 | |
| B. | 硅单质广泛用于光纤通讯 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).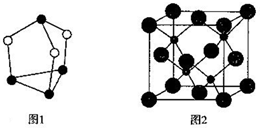
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、HCl、HF | B. | K、Mg、Na | ||
| C. | MgO、NaCl、KBr | D. | 晶体硅、碳化硅、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
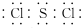 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com