
| A. | 向某溶液中滴加KSCN 溶液,溶液呈血红色,证明存在Fe3+ | |
| B. | 氢氧化钠溶液保存在带橡皮塞的试剂瓶中 | |
| C. | 漂白粉常作环境消毒剂 | |
| D. | 工业上用电解饱和食盐水来制取金属钠 |
分析 A.Fe3+滴加KSCN溶液变血红色;
B.氢氧化钠能够与二氧化硅反应,不能使用玻璃塞的试剂瓶;
C.漂白粉具有强氧化性;
D.工业上用熔融的氯化钠获得钠.
解答 解:A.加KSCN溶液,溶液呈血红色,证明存在Fe3+,故A正确;
B.氢氧化钠溶液能够与玻璃塞中的二氧化硅反应,不能使用玻璃塞的试剂瓶,可以使用带橡胶塞的试剂瓶保存,故B正确;
C.漂白粉具有强氧化性,则常作环境消毒剂,故C正确;
D.工业上用熔融的氯化钠获得钠,而不是电解饱和食盐水,故D错误.
故选D.
点评 本题考查物质的性质,综合考查元素化合物知识,把握性质与用途的关系为解答的关键,注重基础知识的考查,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
 ,氯化钙
,氯化钙 ,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体.
,硫化氢 结构式:H-S-H.以上三种物质中其中属于共价化合物的是H2S,晶体类型为分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
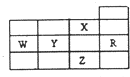
| A. | P亚层未成对电子最多的是Z元素 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W元素的第一电离能小于Y元素的第一电离能 | |
| D. | X元素是电负性最大的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、NaHCO3、NaCl、HCl | B. | Na2CO3、NaHCO3、HCl、NaCl | ||
| C. | (NH4)2SO4、NH4Cl、NaNO3、Na2CO3 | D. | NH4Cl、(NH4)2SO4、Na2CO3、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 过滤时,应用玻璃棒搅拌漏斗中的待过滤液体 | |
| D. | 称量时,称量物放在称量纸(或称量器皿)上,置于托盘天平的左盘;砝码放在托盘天平的右盘中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19世纪初,化学家维勒提出了有机化学的概念 | |
| B. | 自然界存在或不存在的有机物都可以利用人工合成出来 | |
| C. | 有机化合物的定量分析法最早由瑞典化学家贝采里乌斯提出的 | |
| D. | 著名的有机合成化学家李比希曾说:“有机合成的威力体现为在老的自然界旁边再建立起一个新的自然界.” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{6A%}{7}$ | B. | $\frac{(1-A%)}{7}$ | C. | $\frac{6(1-A%)}{7}$ | D. | (100-$\frac{7A}{6}$)% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com