
分析 (1)氧化铝不但可以和酸反应还可以和碱反应均生成盐和水,属于两性氧化物,据此书写离子反应方程式;
(2)Al(OH)3是氢氧化物,能与酸起反应,又能与强碱溶液起反应生成盐和水,属于两性氢氧化物,据此书写离子反应方程式.
解答 解:(1)碱性氧化物只与酸反应生成盐和水,酸性氧化物只与碱反应生成盐和水,两性氧化物既能与酸反应又能与碱反应生成盐和水,氧化铝属于两性氧化物,如Al2O3和盐酸反应生成氯化铝和水,Al2O3和水需要保留化学式,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式:Al2O3+2OH-=AlO2-+H2O,
故答案为:两性;Al2O3+6H+=2Al3++3H2O;Al2O3+2OH-=AlO2-+H2O;
(2)Al(OH)3是氢氧化物,能与酸起反应,又能与强碱溶液起反应生成盐和水,属于两性氢氧化物,如氢氧化铝和盐酸的反应,离子方程式为Al(OH)3+3H+=Al3++3H2O,氢氧化铝和氢氧化钠溶液的反应生成偏铝酸钠和水,离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:两性;Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查了两性氧化物、氢氧化物的判断,侧重于铝的化合物性质的考查,注意离子方程式的书写规范,题目难度不大.


科目:高中化学 来源: 题型:解答题
 有如图所示的装置:
有如图所示的装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O3与O2互为同分异构体 | B. | O3与O2互为同素异形体 | ||
| C. | 使用时浓度大小对人体无害 | D. | O3遇氟氯烷烃不会分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeCl2溶液中通入Cl2:2 Fe2++Cl2=2 Fe3++2Cl- | |
| B. | Al2O3与NaOH溶液反应:Al2O3+2OH-=2 AlO2-+H2O | |
| C. | FeCl3溶液与铜:Fe3++Cu=Fe2++Cu2+ | |
| D. | Cl2溶于水:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
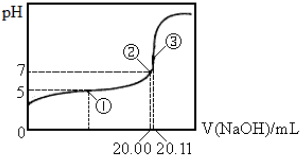
| A. | 该温度下CH3COOH的电离平衡常数Ka=2.0×10-5 | |
| B. | ③点所示溶液中:c(CH3C00-)+c(CH3C00H)=(Na+)+c(0H-) | |
| C. | 该醋酸的浓度为0.1006mol•L-1 | |
| D. | 由图示可以计算醋酸钠的水解平衡常数为5.0×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇可以氧化为乙醛或乙酸,三者都能发生酯化反应 | |
| B. | 苯酚钠溶液中通入CO2生成苯酚,表明苯酚的酸性比碳酸的强 | |
| C. | 乙酸乙酯在酸性或碱性条件下都能发生水解反应 | |
| D. | 可用FeCl3溶液来区分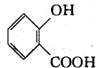 和 和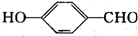 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com