
| A. | 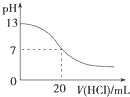 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. |  图中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 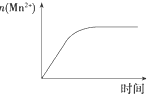 图表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 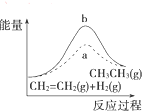 图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)-→CH3CH3(g)△H<0使用和未使用催 化剂时,反应过程中的能量变化 |
分析 A、酸碱中和的时候pH会突变;
B、该反应为放热反应,温度升高,平衡向着逆向移动,K(逆)增大、K(正)减小;
C.n(Mn2+)开始为0,随反应的发生,增大,氧化还原反应结束后,其物质的量不再变化;
D.催化剂降低反应所需的活化能;
解答 解:A、用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,故A错误;
B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K(逆)会增大,而K(正)会减小,图象中变化与实际上的变化相符,故B正确;
C、n(Mn2+)开始为0,随反应的发生,增大,氧化还原反应结束后,其物质的量不再变化,与图象一致,故C正确;
D、催化剂降低反应所需的活化能,反应的始态、终态相同,曲线a为使用催化剂的情况,与图象一致,故D正确;
故选BCD.
点评 本题考查角度广,难度较大,熟悉酸碱中和、平衡常数,反应中的能量变化及图象的含义即可解答,对学生能力要求较高.


科目:高中化学 来源: 题型:选择题
| A. | 向鸡蛋溶液中滴入饱和硫酸钠溶液,析出白色沉淀 | |
| B. | 加热胆矾得到白色的无水硫酸铜粉末 | |
| C. | 向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体 | |
| D. | 向鸡蛋白溶液中滴入硝酸铅溶液,析出白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.75mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=1.0mol/(L•s) | D. | v(D)=0.8mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠着火后,可用泡沫灭火器来灭火 | |
| B. | 氧化钠和过氧化钠都属于碱性氧化物 | |
| C. | 氧化钠和过氧化钠的组成元素相同,都可以与CO2反应且产物相同 | |
| D. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol NH4Cl | B. | 0.1mol NH4NO3 | ||
| C. | 1.204×1023个CO(NH2)2 | D. | 0.2mol NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com