
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:X2Y>X2R | |
| B. | WY2能与碱反应,但不能与任何酸反应 | |
| C. | Z与Y形成的化合物不能作为耐高温材料 | |
| D. | 原子半径按X、Y、Z、R、W的顺序依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符 号 | 元素原子结构 |
X | 原子结构示意图为 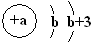 |
| Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Po的晶体堆积模型是简单立方堆积,其配位数是8 | |
| B. | 原子晶体中原子以共价键结合,具有键能大,熔点高,硬度大的特点 | |
| C. | 氯化钠晶体中,每个晶胞中平均含有4个钠离子和4个氯离子 | |
| D. | 在冰晶体中,每一个水分子周围有4个水分子紧密相邻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
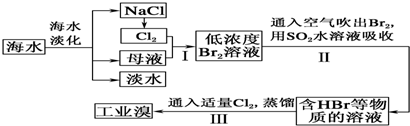
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2COOH | B. | CH3CH2CH2OH | C. | CH2CHCOOCH3 | D. | HOCH2CH2CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com