
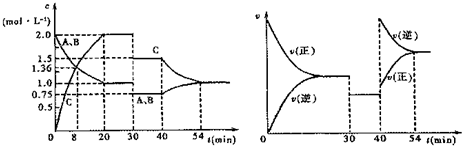
| A. | 反应方程式中的x=1 | |
| B. | 该反应为放热反应 | |
| C. | 30 min时改变的条件是加入催化剂 | |
| D. | 前30 min内A的反应速率为0.05 mol/(L•min) |
分析 由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,
由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,以此解答该题.
解答 解:A.由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,因正逆反应速率相等,则1+x=2,x=1,故A正确;
B.40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故B正确;
C.由A可知,30 min时改变的条件是减小压强,故C错误;
D.前30 min内A的反应速率为v=$\frac{2mol/L-0.75mol/L}{30min}$=0.042mol/(L•min),故D错误.
故选AB.
点评 本题考查化学平衡图象问题,侧重于学生的分析、计算能力的考查,为高考常见题型,题目难度较大,本题注意根据图象浓度的变化以及反应速率的变化判断化学反应状态以及影响化学反应速率的条件,本题易错,答题时注意思考.


科目:高中化学 来源: 题型:选择题
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.往溶液滴加NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.往溶液滴加NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )| A. | 溶液中的阳离子只有H+、NH4+、Mg2+、Al3+ | |
| B. | 溶液中n(NH4+)=0.2mol | |
| C. | 溶液中一定不含CO32-,可能含有SO42-和NO3- | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 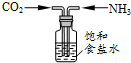 a-模拟工业制纯碱 | B. | 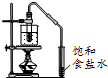 b-制乙酸乙酯实验中接受产物 | ||
| C. | 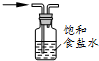 c-除去氯气中的氯化氢 | D. | 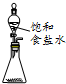 d-实验室制乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸的脱水性是化学性质 | |
| B. | 使铁、铝钝化表现了强氧化性 | |
| C. | 制备乙酸乙酯的反应中起催化脱水作用 | |
| D. | 与氯化钠固体共热制氯化氢气体时,表现强酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置可干燥、收集并吸收多余的NH3 | |
| B. |  装置除去CO2中含有的少量HCl | |
| C. |  装置可以制备大量的乙炔气体 | |
| D. |  装置不添加任何仪器即可检查气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2漂白纸浆 | B. | 纯碱清洗油污 | ||
| C. | Na2S除污水中的Cu2+ | D. | 漂白粉漂白织物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com