
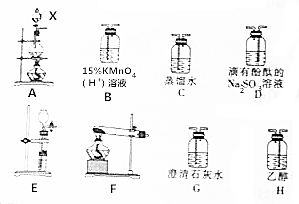
 CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.
CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.分析 本题是利用甲醇与浓盐酸反应制备CH3Cl,涉及具体的制备过程是先在干燥的HCl气流中加热ZnCl2晶体得到无水ZnCl2,再将无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶并滴加一定量的甲醇,经加热后会有CH3Cl生成,因CH3Cl中混有挥发出的HCl及甲醇,选择排水法收集生成的气体的同时还可以除杂,另外还探究了的稳定性及含有CH3Cl尾气的处理;
(1)X仪器为分液漏斗;
(2)根据题干信息可得,制备CH3Cl的化学方程式为CH3OH+HCl(浓)$→_{ZnCl_{2}}^{加热}$CH3Cl+H2O;
(3)当有两种反应物参加反应时,可通过提高一种反应物的量提高另一种反应物的转化率;
(4)用A装置制备CH3Cl,C装置除去挥发出来的HCl,B装置制备氯气,D装置检验氯气的产生,G装置吸收多余的氯气,防止空气污染,
①为验证其氧化产物氯气,选择装置的先后顺序是ACBDG;
②连接好装置后,首先进行的操作是检查装置的气密性;
③Na2SO3溶液呈碱性,滴有酚酞的溶液为红色,同时Na2SO3具有较强还原性,与强氧化性物质Cl2会被氧化成Na2SO4溶液,装置D的实验现象是溶液红色逐渐褪去.
解答 解:(1)看图知X仪器为分液漏斗,
故答案为:分液漏斗;
(2)根据题干信息可得,制备CH3Cl的化学方程式为CH3OH+HCl(浓)$→_{ZnCl_{2}}^{加热}$CH3Cl+H2O,
故答案为:CH3OH+HCl(浓)$→_{ZnCl_{2}}^{加热}$CH3Cl+H2O;
(3)当有两种反应物参加反应时,可通过提高一种反应物的量提高另一种反应物的转化率,
故答案为:增大盐酸的量以提高甲醇的转化率;
(4)用A装置制备CH3Cl,C装置除去挥发出来的HCl,B装置制备氯气,D装置检验氯气的产生,G装置吸收多余的氯气,防止空气污染,
①为验证其氧化产物氯气,选择装置的先后顺序是ACBDG,故答案为:ACBDG;
②连接好装置后,由于氯气有毒,实验前首先进行装置的气密性的检查,故答案为:检查装置的气密性;
③Na2SO3溶液呈碱性,滴有酚酞的溶液为红色,同时Na2SO3具有较强还原性,与强氧化性物质Cl2会被氧化成Na2SO4溶液,装置D的实验现象是溶液红色逐渐褪去,故答案为:溶液红色逐渐褪去.
点评 本题考查了甲醇和浓盐酸混合加热制一氯甲烷的实验原理,涉及实验操作、盐类水解、物质的性质检验及反应原理的探究,综合性较强,但基础性知识偏多,难度不大,离子方程式的书写错误率可能偏高点.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数c>d,离子的还原性Y2->Z- | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 原子半径X<W,第一电离能X<W | D. | 电负性Z>Y>W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
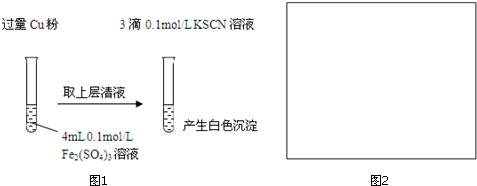
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| :步骤2:取取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CHCOO-) | |
| B. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCl)>Ksp(Ag2CrO4),则AgCl的溶解度大于Ag2CrO4 | |
| D. | 醋酸溶液加少量水稀释$\frac{c(C{H}_{3}COOH)}{C({H}^{+})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NO | B. | 1 mol NO2和0.05 mol O2 | ||
| C. | 2 mol O2 | D. | 0.25 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
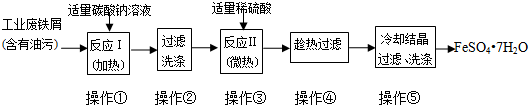
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com