
分析 n(HCl)=0.1L×0.3mol/L=0.03mol,n(H2SO4)=0.3L×0.25mol/L=0.075mol,以此计算n(H+),结合c=$\frac{n}{V}$、pH=-lgc(H+)计算.
解答 解:n(HCl)=0.1L×0.3mol/L=0.03mol,n(H2SO4)=0.3L×0.25mol/L=0.075mol,
n(H+)=0.03mol+0.075mol×2=0.18mol,
c(H+)=$\frac{0.18mol}{0.5L}$=0.36mol/L,
pH=0.44.
故答案为:0.36mol/L;0.44.
点评 本题考查了混合液中物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,试题侧重基础知识的考查,培养学生灵活应用所学知识的能力.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | dacb | B. | bcad | C. | acbd | D. | dcba |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③①④⑤ | B. | ①②③⑤④ | C. | ③②①⑤④ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的烧碱溶液除去瓷器表面污垢 | |
| B. | 铝制餐具不宜长时间存放酸性、碱性或咸的物质 | |
| C. | 漂白粉长期放置空气中会被空气中的氧气氧化而变质 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中:Na+、K+、Al3+、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
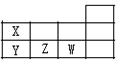
| A. | 原子半径:Y>Z>W | B. | 酸性:HWO4>HXO3>H3YO4 | ||
| C. | 热稳定性:HW>XH3>YH3 | D. | 离子半径:Y3-<Z2-<W- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com