
| A、3:1 | B、1:3 |
| C、4:1 | D、1:4 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属单质与盐溶液的反应都是置换反应 |
| B、4Fe(OH)2+O2+2H2O═4Fe(OH)3属于化合反应 |
| C、SO2+Cl2+2H2O═2HCl+H2SO4属于氧化还原反应 |
| D、反应AgNO3+HCl═AgCl↓+HNO3不能说明盐酸酸性比硝酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有K2CO3 |
| B、肯定有Ba(NO3)2 |
| C、肯定有Na2SO4 |
| D、肯定有CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
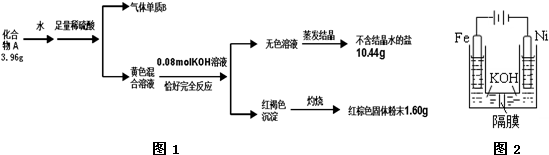
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b>c+d |
| B、若从正反应开始,平衡时,A、B的转化率相等,则投入A、B的物质的量之比为 a:b |
| C、若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d |
| D、若a+b=c+d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com