
【题目】铁及其化合物在人类的生活生产中有着重要的作用,Fe2+、Fe3+是影响水质的一个重要因素。回答下列问题:
I:测量某河水样本中铁的含量
(1)水样中Fe2+的含量越大,溶解氧的含量就越低,用离子方程式解释原因___________。
(2)测定Fe2+取5mL c mo/L的KMnO4标准液,稀释至100mL。取10.00mL河水水样,加入稀硫酸后,用稀释后的KMnO4溶液进行滴定,用去KMnO4溶液V1mL。
①用___________(填滴定管的名称)盛放KMnO4标准液。
②滴定达到终点的标志是___________。
(3)测定Fe3+:取10.00mL水样,转移至盛有过量锌粒的烧杯中充分反应。加入过量稀硫酸,用表面皿盖住烧杯并加热10分钟。冷却后用(2)中稀释后的KMnO4溶液滴定,消耗KMnO4溶液V2mL。
①锌粒的作用是___________。
②河水中Fe3+的浓度是___________mol/L(用含字母的代数式表示)。
Ⅱ:氢氧化亚铁[Fe(OH)2]在常温常压下为白色固体。
(4)当溶液中的离子浓度<1×10-5mol·L-1时,可以认为该离子已沉淀完全。已知常温Fe(OH)2的Ksp为8.0×10-16。现调节含Fe2+的某河水样品pH=9,用简要计算过程说明Fe2+是否已经达到沉淀完全:___________。
(5)一种用Na2SO4溶液做电解液,电解制取Fe(OH)2的实验装置如图所示。通电后,溶液中产生白色沉淀,且较长时间不变色。

①必须使用铁电极的是___________(填“A"或“B”)极。
②B电极的电极反应式为___________。
【答案】4Fe2++O2+4H+=4Fe3++2H2O 酸式滴定管 滴入最后一滴KMnO4溶液,紫色不褪,并在半分钟保持不变 将Fe3+还原 2.5![]() 10-2c(V2-V1) pH=9时,c(Fe2+)=
10-2c(V2-V1) pH=9时,c(Fe2+)=![]() =8.0
=8.0![]() 10-6mol/L<1
10-6mol/L<1![]() 10-5mol/L,Fe2+已经沉淀完全 A 2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑
10-5mol/L,Fe2+已经沉淀完全 A 2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑
【解析】
(1) 酸性条件下,O2在水中被Fe2+还原,以此写出离子方程式;
(2)①KMnO4标准液具有强氧化性,能腐蚀橡胶,要用酸式滴定管盛放;
②用KMnO4标准液滴定Fe2+,终点时KMnO4溶液过量,出现紫色,以此分析解答;
(3)取10.00mL水样,与过量锌粒充分反应后Fe3+和Fe2+都被还原为Fe,再加入过量稀硫酸将Fe转化为Fe2+,根据反应关系,5Fe2+~MnO4--计算;
(4)根据c(Fe2+)=![]() 计算;
计算;
(5)①由装置图可知,电解装置的A电极与电源正极相连,则A为阳极,阳极为铁失电子发生氧化反应,据此解答;
②B电极为阴极,阴极水得电子发生还原反应,据此书写电极反应式;
(1) 酸性条件下,O2在水中被Fe2+还原,则溶解氧的含量降低,离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(2)①KMnO4标准液具有强氧化性,能腐蚀橡胶,要用酸式滴定管盛放;
故答案为:酸式滴定管;
②用KMnO4标准液滴定Fe2+,当出现紫色时,说明Fe2+已滴定完全,故滴定达到终点的标志是滴入最后一滴KMnO4溶液,紫色不褪,并在半分钟保持不变;
故答案为:滴入最后一滴KMnO4溶液,紫色不褪,并在半分钟保持不变;
(3)取10.00mL水样,与过量锌粒充分反应后Fe3+和Fe2+都被还原为Fe,再加入过量稀硫酸将Fe转化为Fe2+,
①根据以上分析,锌粒的作用是将Fe3+还原;
②滴定时溶液中的Fe2+包括两部分,一部分是水样中原来就有的,另一部分是由Fe3+转化而来的,根据反应关系,5Fe2+~MnO4-,
滴定时消耗的MnO4-的物质的量为n(MnO4-)2=![]() c
c![]() mol=5
mol=5![]() 10-5cV2 mol,
10-5cV2 mol,
滴定水样中原有Fe2+消耗的MnO4-的物质的量为n(MnO4-)1=![]() c
c![]() mol=5
mol=5![]() 10-5cV1 mol,
10-5cV1 mol,
则水样中Fe3+的物质的量为(5![]() 10-5cV/span>2-5
10-5cV/span>2-5![]() 10-5cV1)
10-5cV1)![]() 5=2.5
5=2.5![]() 10-4c(V2-V1) mol,
10-4c(V2-V1) mol,
则河水中Fe3+的浓度是![]() =2.5
=2.5![]() 10-2c(V2-V1)mol/L;
10-2c(V2-V1)mol/L;
故答案为:将Fe3+还原;2.5![]() 10-2c(V2-V1);
10-2c(V2-V1);
(4)根据Fe(OH)2的Ksp为8.0×10-16,pH=9时,c(Fe2+)=![]() =8.0
=8.0![]() 10-6mol/L<1
10-6mol/L<1![]() 10-5mol/L,Fe2+已经沉淀完全;
10-5mol/L,Fe2+已经沉淀完全;
故答案为:A;
(5)①由装置图可知,电解装置的A电极与电源正极相连,则A为阳极,阳极为铁失电子发生氧化反应,故必须使用铁电极的是A极;
②B电极为阴极,阴极水得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑;
故答案为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯的物质与人们的生活密切相关。已知氯元素常见的化合价有-1、0、+1、+3、+5、+7六种,其不同价态的物质间可相互转化。回答下列问题:
(1)氯原子的原子结构示意图___;氯离子的电子式___。
(2)氯气能使湿润的有色布条褪色,起到漂白作用的物质是____(写名称),漂粉精的主要有效成分是___(写化学式)。
(3)实验室制取氯化氢的化学方程式____。
(4)工业上将含有氯气的尾气通过___进行处理,在处理时发生的反应中氯气作为____。
a.氧化剂 b.还原剂 c.既是氧化剂又是还原剂 d.既不是氧化剂又不是还原剂
(5)写出氯气的两种用途____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如下图所示。据图判断错误的是( )

A. a的数值一定大于9
B. Ⅱ为氨水稀释时溶液的pH变化曲线
C. 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D. 完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积:V(NaOH)<V(氨水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为100mL浓度均为1molL的 NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下:

下列分析正确的是
A. CO2通入 NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B. CO2通入 CH3COONa溶液的反应:CO2+H2O+ CH3COO-=HCO3-+ CH3COOH
C. 通入n(CO2)=0.06mol,NaOH溶液的反应:2OH-+CO2=CO32-+H2O
D. 通入n(CO2)=0.06mol,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.06mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W是药物合成的中间体,它的一种合成路线如下:

回答下列问题:
(1)试剂a是___________。
(2)A的名称是___________;F中官能团的名称是___________。
(3)下列说法正确的是___________(填正确选项编号)。
a.CH2= CHCHO不存在顺反异构体 b.D能发生水解反应
c.E的分子式为C9H14NO2 d.⑧发生了还原反应
(4)反应③的化学方程式是___________。
(5)G(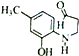 )有多种同分异构体。属于丁酸酯且苯环上含一NH2的同分异构体有___________种,其中核磁共振氢谱显示为6组峰,且峰面积之比为3:2:2:2:2:2的结构简式为___________。
)有多种同分异构体。属于丁酸酯且苯环上含一NH2的同分异构体有___________种,其中核磁共振氢谱显示为6组峰,且峰面积之比为3:2:2:2:2:2的结构简式为___________。
(6)  是制药中间体,结合题中流程和已学知识设计由D为起始原料合成
是制药中间体,结合题中流程和已学知识设计由D为起始原料合成 的合成路线图:___________(无机试剂任选)。
的合成路线图:___________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图可设计成多种用途的电化学装置,下列说法错误的是

A. a与电源正极相连时,铜做阳极
B. a和b用导线连接时,锌做负极
C. a和b用导线连接时,铜片上发生的反应为:2H++2e -=H2↑
D. a与电源正极相连可以保护锌片,称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分前四周期元素的性质或原子结构如下表:

(1)B单质分子中,含有________个![]() 键和__________个
键和__________个![]() 键,元素B的气态氢化物的空间型为________________。
键,元素B的气态氢化物的空间型为________________。
(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() 2.14),向20mL0.01molL-1HNO2溶液中逐滴加入相同浓度的NOH溶液,测得混合液的 pH随NaOH溶液体积的变化如图所示,下列判断正确的是
2.14),向20mL0.01molL-1HNO2溶液中逐滴加入相同浓度的NOH溶液,测得混合液的 pH随NaOH溶液体积的变化如图所示,下列判断正确的是

A. X=20
B. a、b、c、d四点对应的溶液中水的电离程度逐渐减小
C. a点溶液中c(H-)=2.14×10-3molL-1
D. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>c(NO2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com