
| A. | 二氧化碳和氮气 | B. | 二氧化碳和二氧化氮 | ||
| C. | 二氧化碳和氧气 | D. | 氮气和氧气 |
分析 根据质量守恒定律,化学反应前后各原子的种类和数目不变,反应前各原子的数目之和等于反应后各原子的数目之和,反应物为NO、CO,则产物也由氮、碳、氧三种元素组成,转化为参与大气循环的无毒混合气体,所以该反应为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,据此分析解答.
解答 解:A.由题意可知反应物是CO和NO,即反应物中含有C、N、O三种元素,生成物中也必须只能含有C、N、O三种元素,“三效催化净化器”,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的无毒混合气体,所以该反应为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故A正确;
B.二氧化氮为有毒气体,且为大气污染物,故B错误;
C.二氧化碳和氧气,产物中没有N元素,不满足质量守恒定律,故C错误;
D.氧气的氧化性较强,不会被CO或NO氧化生产氧气,故D错误;
故选A.
点评 本题主要考查大气污染物及其治理方法,题目难度不大,明确质量守恒定律及氧化还原反应中化合价变化规律为解答关键,注意掌握氮、碳的单质及其氧化物的性质.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| B. | 若 2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. |  如图可表示水分解过程中的能量变化 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:SiO2>NaCl>S>CO2 | B. | 酸性:HNO2<HNO3;H3PO4<H2SO4 | ||
| C. | 还原性:H2S>HI>HBr>HCl | D. | 键长:C-H<N-H<O-H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2溶于水反应,反应转移电子数为nA | |
| B. | 56g晶体硅中含有硅分子数为2nA | |
| C. | 1 mol Cu和足量稀硝酸反应产生nA个NO分子 | |
| D. | 标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸用铜制容器密封保存 | |
| B. | SO2能使溴水褪色,体现其漂白性 | |
| C. | 氨气是电解质,因为氨气的水溶液能导电 | |
| D. | 光导纤维的主要成分是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.7g | B. | 23.4 g | C. | 26.5g | D. | 58.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸的电离 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
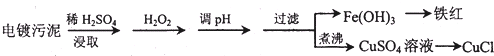
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com