
| A. | AD盐溶液pH>7 | B. | .酸的电离程度一定是HD<HC | ||
| C. | .碱的电离程度一定是AOH>BOH | D. | .在AC盐溶液中c(A+)+c(AOH)=c(C-)+c(HC) |
分析 AC、BD的pH=7,则可能为强酸强碱盐或弱酸弱碱盐,BC溶液的pH>7,则为强碱弱酸盐,由此可知,BD为强酸强碱盐,而AC为弱酸弱碱盐,以此解答.
解答 解:AC、BD的pH=7,则可能为强酸强碱盐或弱酸弱碱盐,BC溶液的pH>7,则为强碱弱酸盐,由此可知,BD为强酸强碱盐,而AC为弱酸弱碱盐,
A.AD盐溶液是强酸弱碱盐溶液,水解溶液呈酸性,所以pH<7,故A错误;
B.D-对应的酸比C离子对应的酸酸性强,所以酸的电离程度一定是:HD>HC,故B错误;
C.离子对应的碱的碱性比B离子对应的碱的碱性弱,所以碱的电离程度一定是:AOH<BOH,故C错误;
D.AC盐溶液中,AC为弱酸弱碱盐溶液中阴阳两种离子,都要水解,根据物料守恒:c(A+)+c(AOH)=c(C-)+c(HC),故D正确.
故选D.
点评 本题考查盐类水解规律的应用,为高频考点,侧重于学生的分析能力的考查,明确盐中有弱才水解的规律是解答本题的关键,注意AC可能为醋酸铵,题目难度中等.


科目:高中化学 来源: 题型:解答题
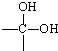 →
→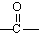 +H2O烃A(分子式为C9H8)有如图的转化关系:
+H2O烃A(分子式为C9H8)有如图的转化关系:
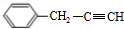 ,指出反应①的反应类型:加成反应.
,指出反应①的反应类型:加成反应. .
.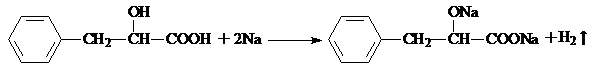 .
.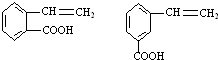 ,请写出其他两种
,请写出其他两种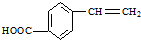 、
、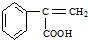 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅石常用作光导纤维、光学仪器的原料 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | 酚醛树脂可作木材粘合剂、制作食用器具 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 TiO2•XH2O↓+4HCl
TiO2•XH2O↓+4HCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-) | |
| B. | 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-) | |
| C. | 向0.1 mol/L醋酸溶液中加水稀释的过程中c(OH-)不断增大 | |
| D. | 向含有Na2SO4的BaSO4悬浊液中加水稀释,c(Ba2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1molH-H键需要的能量小于断开1molCl-Cl键需要的能量 | |
| B. | 反应在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能小于反应②的活化能 | |
| D. | 已知反应②的△H>0,则反应③的△H一定小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 用某无色溶液进行焰色反应 | 焰色呈黄色 | 原溶液一定是钠盐溶液 |
| B | 向NaOH溶液中滴加足量的MgCl2 溶液,然后再滴加足量的CuCl2溶液 | 先产生白色沉淀, 然后沉淀变蓝色 | KSP[Cu(OH)2]>KSP[Mg(OH)2] |
| C | 将水蒸汽通过灼热的铁粉 | 粉末变红 | 铁与水蒸汽在高温下发生 反应 |
| D | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g)═N2O4(g) △H<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Fe2+、Cl- | B. | K+、Fe3+、NO3-、Fe(OH)3(胶体) | ||
| C. | Cl-、SCN-、NH4+、葡萄糖分子 | D. | OH-、Na+、苯酚、Br - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com