
| A. | Al2O3(SiO2):NaOH溶液 | B. | CO2(SO2):饱和的Na2CO3溶液 | ||
| C. | NaHCO3溶液(Na2CO3溶液):Ca(OH)2溶液 | D. | FeCl2溶液(FeCl3):Fe粉 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | p2<p1 | B. | p1<p2<2p 1 | C. | p1>2p2 | D. | 2p1=p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: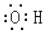 | ||
| C. | 苯酚的结构简式为C6H5OH | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
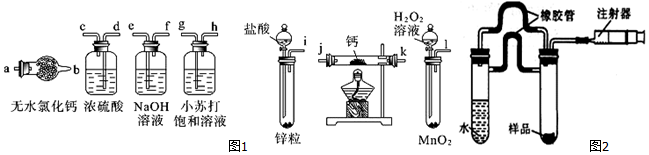
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
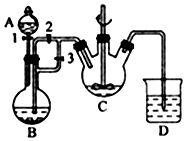 (1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为2BrO3-+10I-+12H+=5I2+Br2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
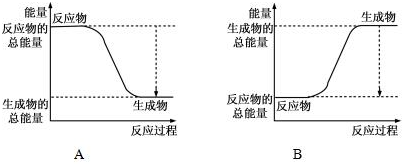
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com