
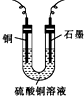
 当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示:
当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示: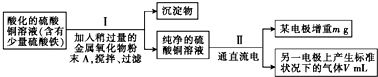
| V×10 -3L |
| 22.4L/mol |
| V |
| 22400 |
| m |
| M r |
| V |
| 22400 |
| 11200m |
| V |
| 11200m |
| V |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有漂白性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2样品已氧化变质 |
| C | 将新制氯水和KI溶液在试管中混合后,加入CCl4,振荡静置 | 溶液分层,下层呈紫色 | 氧化性:Cl2>I2 |
| D | 分别向0.1 mol?L-1醋酸和饱和硼酸溶液中滴加0.1mol?L-1Na2CO3溶液 | 醋酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O (l)△H=-285.8 kJ?mol-1 |
| B、2H2(g)+O2(g)=2H2O (l)△H=+571.6 kJ?mol-1 |
| C、2H2(g)+O2(g)=2H2O (g)△H=-571.6 kJ?mol-1 |
| D、H2(g)+1/2O2(g)=H2O (l)△H=-285.8 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2、Na2CO3 |
| B、Na2CO3、NaOH |
| C、Na2CO3、NaHCO3 |
| D、Na2CO3、Na2O2、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①443-573K |
| 熔烧 |
| ②进一步加热 |
| 到773-873K |
| 通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com