
| A、纯铜作阳极,含Zn和Ag的铜合金作阴极 |
| B、含Zn和Ag的铜合金作阳极,纯铜作阴极 |
| C、用纯铁作阳极,纯铜作阴极 |
| D、用石墨作阳极,纯铜作阴极 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9.3×10-5 mol/L |
| B、9.7×10-9 mol2/L2 |
| C、7.6×10-17 mol4/L4 |
| D、8.7×10-9 mol2/L2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.33×10-4 |
| B、1×10-5 |
| C、1×10-10 |
| D、1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、元素④、⑦、⑨的单质的氧化性依次减弱,所以在水溶液中④的单质可以置换出⑦、⑨的单质 |
| B、因为氢键关系,气态氢化物的稳定性③大于⑥ |
| C、元素⑤的单质与元素②的最高价氧化物对应的水化物反应时,参加反应的⑤单质与生成氢气的物质的量之比为2:3 |
| D、离子半径:⑥>⑦>③>④>⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加少量MgCl2 |
| B、加入NH4Cl固体 |
| C、适当升高温度 |
| D、加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
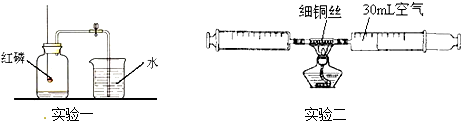
| A、2个 | B、3个 | C、4个 | D、5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40gNaOH溶于1L水所得的溶液 |
| B、将80g SO3溶于水并配成1L的溶液 |
| C、将0.5mol/L的NaNO3溶液100mL加热蒸发掉50g水的溶液 |
| D、含K+为2mol的K2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com