
 ,其最高正价为+7;是第四周期ⅦB族.
,其最高正价为+7;是第四周期ⅦB族. 分析 (1)①根据A- 1s22s22p63s23p6,说明A-核外有18个电子,则A核电荷数为17,据此判断;
②根据B原子 2s22p3,说明B核电荷数为7,据此判断;
(2)该元素的基态原子的外围电子排布式为3d54s2,则最高正化合价为+7,位于元素周期表中第四周期ⅦB族,据此分析.
解答 解:(1)①根据A- 1s22s22p63s23p6,说明A-核外有18个电子,则A核电荷数为17即氯元素,所以在第三周期第ⅦA族,故答案为:三;ⅦA;
②根据B原子 2s22p3,说明B核电荷数为7即氮元素,所以在第二周期第ⅤA族,故答案为:二;ⅤA;
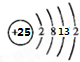
(2)该元素的基态原子的外围电子排布式为3d54s2,说明该元素核电荷数为25即Mn元素,所以原子结构示意图为 ,最高正化合价为+7,位于元素周期表中第四周期ⅦB族,故答案为:
,最高正化合价为+7,位于元素周期表中第四周期ⅦB族,故答案为: ;+7;四;ⅦB.
;+7;四;ⅦB.
点评 本题考查了核外电子排布规律、元素在周期表位置的判断,难度不大,理解核外电子排布规律是关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3和 Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含有Cl- | |
| B. | 某溶液中先滴加稀硝酸酸化,再滴加几滴Ba(NO3)2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内每减少1mol A2,同时生成2mol AB3 | |
| B. | 容器内每减少1mol A2,同时消耗3mol B2 | |
| C. | 容器内每减少1mol A2,同时消耗1mol B2 | |
| D. | 容器内每减少1mol A2,同时生成3mol B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 g甲基(-CH3)所含电子数目为NA | |
| B. | 0.1 mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| C. | 由2H和18O所组成的水11 g,其中所含的中子数为5NA | |
| D. | 1 mol Fe溶于过量硝酸,电子转移数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜和稀盐酸 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 澄清的石灰水和稀硝酸反应 | D. | 醋酸和氢氧化钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水、氢氧化钾溶液、稀盐酸 | B. | 水、氢氧化钠溶液、稀盐酸? | ||
| C. | 水、硝酸银溶液、稀硝酸 | D. | 水、氢氧化钾溶液、稀硝酸? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com