
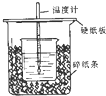
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

科目:高中化学 来源: 题型:
| A、Cl-的浓度不变 |
| B、溶液变浑浊 |
| C、溶液中Al3+全部转化为AlO2- |
| D、溶液中存在最多的离子是Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150ml 1mol?L-1NaCl溶液 |
| B、75ml 2mol?L-1 KClO3溶液 |
| C、150ml 2mol?L-1 KCl溶液 |
| D、75ml 1mol?L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与FeCl3溶液反应:Fe+Fe3+═2 Fe2+ |
| B、小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO2↑+H2O |
| C、金属铝加入到NaOH溶液中:Al+2OH-+H2O═AlO2-+2H2↑ |
| D、钠与水的反应 2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据酸分子中含氢原子个数将酸分为一元酸、二元酸等 |
| B、根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应 |
| C、根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质 |
| D、根据元素原子最外层电子数的多少将元素分为金属和非金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10(2b-a)mol/L |
| B、10(b-a)mol/L |
| C、10(2a-b)mol/L |
| D、10(b-2a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下任何气体的分子间距离几乎相等 |
| B、固体和液体粒子之间的距离和忽略不计 |
| C、构成气体的粒子的大小相对于它们之间的距离可忽略不计 |
| D、一定温度和压强下各种气态物质所占体积的大小,由构成气体的分子大小决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:
实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com