
| +X |
| 反应① |
| X |
| 反应② |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、与O2互为同位素 |
| B、与O2互为同分异构体 |
| C、是氧元素的新单质 |
| D、它不是氧的一种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量金属钠保存在煤油中 |
| B、烧碱溶液盛装在用玻璃塞塞紧的试剂瓶中 |
| C、向石蕊试液中加入新制氯水,石蕊试液先变红后褪色 |
| D、SO2和CO2气体都可以使澄清的石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A、相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、NaClO溶液中通入少量CO2气体的离子方程式:2ClO-+CO2+H2O=CO32-+2HClO |
| C、向0.1mol?L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 |
| D、相同物质的量浓度的下列溶液,pH的大小关系是Na2CO3>NaHCO3>NaClO>CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
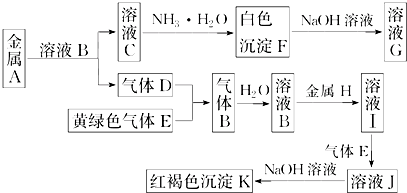
查看答案和解析>>
科目:高中化学 来源: 题型:
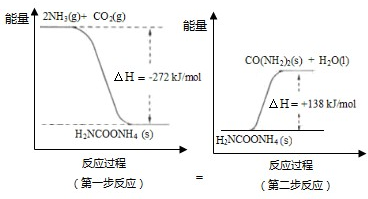
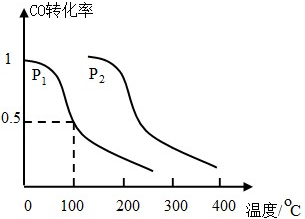
查看答案和解析>>
科目:高中化学 来源: 题型:
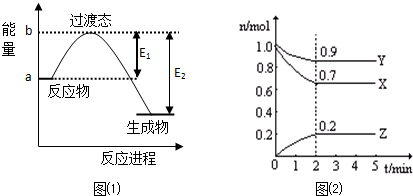
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com