
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)C60分子能与F2发生加成反应,其加成产物为______,C60分子的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为________。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是________(填字母)。
a.晶体的密度:干冰>冰
b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰
d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是________(填字母)。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
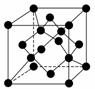
(4)金刚石晶胞结构如下图,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为________,B原子与N原子之间共价键与配位键的数目比为________,一个晶胞中N原子数目为________。
(5)C与孔雀石共热可以得到金属铜,铜原子的原子结构示意图为________,金属铜采用面心立方最密堆积(在晶胞的顶点和面心均含有一个Cu原子),则Cu的晶体中Cu原子的配位数为________。
已知Cu单质的晶体密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为____。
答案 (1)C60F60 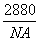 g (2)ac (3)ae
g (2)ac (3)ae
(4)正四面体 3∶1 4
(5) 12
12 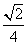 ×
× 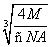 cm
cm
解析 (1)C60中每个碳原子的连接方式为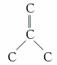 ,所以C60中共有双键0.5×60=30个,则与F2加成的产物应为C60F60;C60为面心立方堆积,则
,所以C60中共有双键0.5×60=30个,则与F2加成的产物应为C60F60;C60为面心立方堆积,则
m·NA=4×12×60 g
m=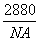 g。
g。
(2)在冰中存在氢键,空间利用率较低,密度较小,a、c正确。
(3)石墨中C—C键键长小于金刚石中C—C键键长,所以熔点:石墨>金刚石,金刚石的碳原子呈sp3杂化,而石墨中的碳原子呈sp2杂化,所以共价键的键角:石墨大于金刚石,石墨属于混合型晶体,a、e正确。
(4)在BN中,B原子周围最近的N原子所构成的立体图形为正四面体形,在四个共价键中,其中有一个配位键,其个数之比为3∶1,在晶胞中,含N:8×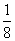 +6×
+6×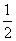 =4个,含B:4个。
=4个,含B:4个。
(5)根据铜的堆积方式,Cu原子的配位数应为12,设晶胞边长为a,
则a3·ρ·NA=4M
a= 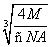
面对角线为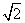 ×
× 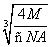 ,其
,其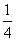 为Cu原子半径,
为Cu原子半径,
即r=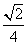 ×
× 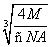 cm。
cm。


科目:高中化学 来源: 题型:
以溴乙烷为主要原料制乙二酸时,经过的最佳途径反应顺序为( )
A.取代—消去—加成—氧化
B.消去—加成—取代—氧化
C.消去—取代—加成—氧化
D.取代—加成—氧化—消去
查看答案和解析>>
科目:高中化学 来源: 题型:
X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y的少6个。下列说法中不正确的是( )
A.X的单质固态时为分子晶体
B.Y的单质为原子晶体
C.X与Y形成的化合物固态时为分子晶体
D.X与碳形成的化合物为分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
关于晶体的叙述中,正确的是( )
A.原子晶体中,共价键的键能越大,熔、沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔、沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
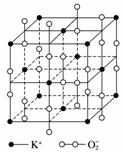
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O
B.晶体中每个K+周围有8个O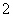 ,每个O
,每个O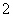 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的符号定为“Cn”,汉语名为“ ”;②合理利用核能符合“低碳经济”的要求,
”;②合理利用核能符合“低碳经济”的要求,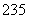 92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
92U是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6,还含有FeO、MgO、CaO等杂质)。下列有关叙述对上述所涉及元素的说法正确的是( )
A.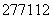 Cn的原子核内中子数与核外电子数之差为55
Cn的原子核内中子数与核外电子数之差为55
B.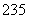 92U和
92U和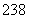 92U是同位素,核反应属于化学变化
92U是同位素,核反应属于化学变化
C.40Ca2+与18O 具有相同的电子数
具有相同的电子数
D.Si2O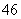 中质子总数为80
中质子总数为80
查看答案和解析>>
科目:高中化学 来源: 题型:
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X能与某些金属元素形成化合物
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X可能形成化学式为KXO3的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是( )
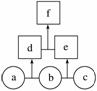
A.常温下,单质a呈气态
B.单质c具有强氧化性
C.稳定性:d>e
D.f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源: 题型:
已知亚硫酸钠在空气中能被氧气氧化生成硫酸盐。
Ⅰ.甲同学设计两种方案来检验Na2SO3溶液是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠溶液没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠溶液完全变质。
请你对两方案作出评价:
方案一:________(填“合理”或“不合理”),理由是_______________________
________________________________________________________________________。
方案二:________(填“合理”或“不合理”),理由是____________________________
________________________________________________________________________。
Ⅱ.乙同学探究Na2SO3溶液是否发生变质,设计如下实验测定1.0 mol·L-1 Na2SO3溶液的实际浓度。
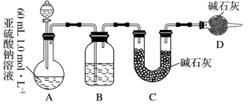
(1)分液漏斗中应加入足量的下列哪种试剂?________(填字母)
a.浓硝酸 b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重3.2 g,则Na2SO3溶液实际的物质的量浓度为________。
(3)该实验装置还存在一个明显的缺陷是________。
答案 Ⅰ.不合理 亚硫酸钠部分变质时滴加盐酸也会产生气泡 不合理 亚硫酸钠也能与氯化钡反应生成白色沉淀,亚硫酸钠未变质或部分变质时也会产生白色沉淀
Ⅱ.(1)b (2)0.83 mol·L-1
(3)缺少一个驱赶残留二氧化硫气体的装置(或其他合理答案)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com