
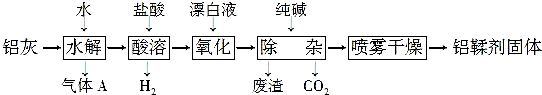
分析 铝灰主要成分为Al、Al2O3、AlN、FeO等,加水发生反应,AlN发生水解生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液pH使铁离子转化为氢氧化铁沉淀,采用喷雾干燥制备铝鞣剂.
(1)AlN水解得到气体A是氨气,加热可以促进氮化铝水解生成氨气,有利于氨气的逸出;
(2)酸溶时使用的酸是盐酸;
(3)加入漂白液的作用是利用次氯酸根离子在酸溶液中的强氧化性,将氧化亚铁离子为铁离子;
(4)由上述分析可知滤渣为氢氧化铁沉淀;可以回收利用生成铁红;
(5)铝鞣剂主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解利用喷雾干燥,减少铝鞣剂水解;
(6)最终得到ng沉淀为AgCl的质量,根据氯离子守恒计算Al(OH)2Cl的质量,进而计算样品中Al(OH)2Cl的质量分数.
解答 解:铝灰主要成分为Al、Al2O3、AlN、FeO等,加水发生反应,AlN发生水解生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液pH使铁离子转化为氢氧化铁沉淀,采用喷雾干燥制备铝鞣剂.
(1)AlN水解得到气体A是NH3,加热可以加快AlN水解反应速率,降低NH3在水中的溶解度,促使NH3逸出,
故答案为:NH3;加快AlN水解反应速率,降低NH3在水中的溶解度,促使NH3逸出;
(2)由流程图可知,酸溶时使用的酸是盐酸,
故答案为:盐酸;
(3)加入漂白液的作用是利用次氯酸根离子在酸溶液中的强氧化性,将氧化亚铁离子为铁离子,反应离子方程式为:2Fe2++2H++ClO-═2Fe3++Cl-+H2O,
故答案为:2Fe2++2H++ClO-═2Fe3++Cl-+H2O;
(4)由上述分析可知,滤渣为Fe(OH)3沉淀;可以回收利用生成铁红,
故答案为:Fe(OH)3;回收利用生成铁红;
(5)铝鞣剂主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解利用喷雾干燥,减少铝鞣剂水解,
故答案为:防止Al(OH)2Cl水解生成Al(OH)3;
(6)最终得到ng沉淀为AgCl的质量,根据氯离子守恒,Al(OH)2Cl的质量=$\frac{ng}{143.5g/mol}$×96.5g/mol,故样品中Al(OH)2Cl的质量分数为($\frac{ng}{143.5g/mol}$×96.5g/mol÷mg)×100%=$\frac{193n}{287m}$×100%,
故答案为:$\frac{193n}{287m}$×100%.
点评 本题考查物质准备工艺流程,涉及对操作的分析评价、对条件控制分析、物质含量测定等,熟练掌握元素化合物知识,树立资源回收再利用意识,是对学生综合能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 氯气的电子式:Cl:Cl | |
| B. | NH4Cl的电子式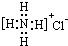 | |
| C. | 钠原子的结构示意图: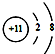 | |
| D. | 硫酸亚铁的电离方程式FeSO4═Fe2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
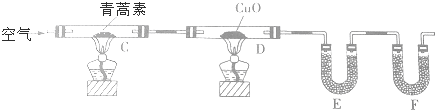
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
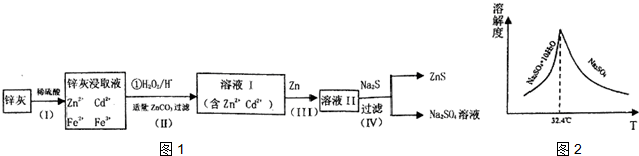
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
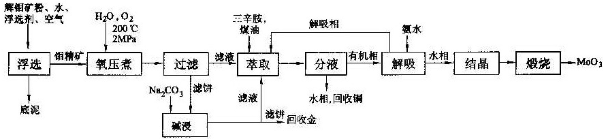
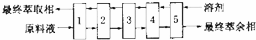
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
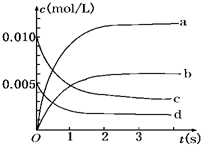 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
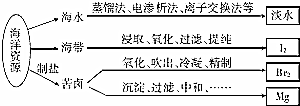
| A. | 从海水中获取淡水,历史最久的方法是离子交换法 | |
| B. | 从海带中获得I2需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等 | |
| C. | 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br- | |
| D. | 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与D可形成含18e-的离子化合物 | |
| B. | B单质在C单质中燃烧生成原子个数比为1:1的化合物 | |
| C. | D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | |
| D. | D与E组成的化合物中,各原子最外层均达到8电子结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com