
【题目】标准状况下VL氨气溶解在lL水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数Ψ,物质的量浓度为cmol/L则下列关系中不正确的是
A. Ψ=17c/(1000p) B. Ψ=17V/(17V+22400)
C. p=17V/(22.4+22.4V)/(17V+22400) D. c=1000Vp/(17V+22400)
【答案】C
【解析】A.根据c=1000ρw/M可知,该氨水质量分数Ψ=17c/(1000p) ,故A正确;
B.标准状况下VL氨气溶解在1L水中,所得溶液的质量为V/22.4×17+1L×1000×1g·mL-1=(V/22.4×17+1000)g,Ψ=17V/22.4÷((V/22.4×17+1000)=17V/(17V+22400),故B正确;
C.标准状况下VL氨气溶解在1L水中,所得溶液的质量为V/22.4×17+1L×1000×1g·mL-1=(V/22.4×17+1000)g,溶液体积为![]() ,,所以溶液的密度为
,,所以溶液的密度为![]() ,,故C错误;
,,故C错误;
D.c=1000Ψρ/Mr,由于Ψ=17V/22.4÷((V/22.4×17+1000),代入公式即得c=1000Vp/(17V+22400),故D正确;


科目:高中化学 来源: 题型:
【题目】工业上可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得NaHSO3溶液以实现吸收液的回收再利用,装置如图所示,则工作一段时间后,下列说法正确的是

A. 电源a端是正极
B. 阴极区的pH减小
C. 阳极的电极反应式为HSO3--2e-+H2O=SO42-+3H+
D. 电路中每通过0.2mol电子,能产生2.24LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、镁、铝各0.3mol分别放入足量的盐酸中,同温同压下产生的气体的体积比是( )
A.1∶1∶1B.1∶2∶3C.6∶3∶2D.3∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素和碳元素形成的单质及化合物在生产、生活中有广泛的用途,
请回答下列问题:
(1)基态Fe原子的价层电子的电子排布图为_________________;其最外层电子的电子云形状为___________。
(2)(NH4)2Fe(SO4)2 6H2O俗称摩尔盐。其阴离子的VSEPR模型名称为____________________。
写出一种与NH4+互为等电子体的分子的电子式:________________________________。
(3)Fe(CO)5可用作催化剂、汽油抗暴剂等.其分子中σ键和π键的数目之比为______________。CO的沸点高于N2的原因是_________________________。
(4)碳元素可形成多种单质。
①石墨烯是从石墨中剥离出来的由单层碳原子构成的平面结构新型碳材料。其中碳原子的杂化方式为______________________。
料,其中碳原子的杂化方式为 ,
②金刚石的晶胞如图所示。若晶胞参数为a pm,阿伏加德罗常数的值为NA,则该晶胞中原子的体积占晶胞体积的百分率为________________;1cm3晶体的平均质量为___________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学已经渗透到人类生活的各个方面,下列说法正确的是
A. 绿色化学的核心是对环境污染进行综合治理
B. 烟、云、雾在阳光照射下可观察到丁达尔效应
C. “温室效应”、“酸雨”的形成都与氮氧化合物有关
D. 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去);
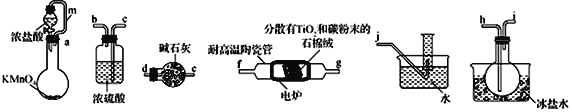
相关信息如下表所示:
熔点/℃ | 沸点/℃ | 密度/(g cm-3) | 水溶性 | |
TiCl4 | -25 | 136 | 1.5 | 易水解,能溶于有机溶剂 |
CC14 | -23 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为_____________(填仪器接口字母)
(2)根据完整的实验装置进行实验,实验步骤如下:检査装置气密性后,装入药品;_____________
(按正确的顺序填入下列操作的字母)。
A.关闭分液漏斗活塞 B.停止加热,充分冷却
C.打开分液漏斗活塞 D.加热装置D中陶瓷管
实验时,当观察到______________时,开始进行步骤D。
(3)装置A中导管m的作用为_______________________。
(4)装置C的作用为 ___________________________________________。
(5)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为__________________________________。
(6)设计实验证明装置 F中收集到的液体中含有TiCl4:______________________________________________。
(7)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的晶体有如下类型:①分子晶体;②离子晶体;③原子晶体;④金属晶体。短周期非金属元素所形成的单质或化合物中,固态时的晶体类型可能是
A.①③B.①③④C.①②③D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 4.6g NO2(g)和N2O4(g)的混合物中含有0.3NA个原子
B. 0.1mol乙酸与足量乙醇发生酯化反应,生成0.1NA个乙酸乙酯分子
C. 常温下将5.6gFe投入足量浓硫酸,电子转移数为0.3NA
D. Na2O2与足量H2O发生反应,每生成2.24L气体(标准状况),电子转移数0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com