
| A. | I->Fe2+>Cl->SO2 | B. | Cl2>Fe3+>I2>SO2 | C. | Fe2+>I->Cl->SO2 | D. | Cl2>Fe3+>SO2>I2 |
分析 氧化还原反应中含有元素化合价降低的物质为氧化剂,通过氧化反应得到的产物为氧化产物,所含元素化合价升高的物质为还原剂,通过还原得到的产物为还原产物,根据氧化剂的氧化性大于还原剂,氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性来判断.
解答 解:①2FeCl3+2KI═2KCl+2FeCl2+I2,氧化剂为FeCl3,氧化产物I2,氧化性顺序是Fe3+>I2,
②2FeCl2+Cl2═2FeCl3,氧化剂为Cl2,氧化产物FeCl3,氧化性顺序是Cl2>Fe3+.
③I2+SO2+2H2O═H2SO4+2HI,氧化剂为I2,氧化产物H2SO4,还原剂是SO2,氧化剂的氧化性大于还原剂,所以氧化性顺序是I2>SO2
所以氧化性顺序是Cl2>Fe3+>I2>SO2.
故选B.
点评 本题考查学生分析和解决问题的能力,可以根据氧化剂的氧化性强于氧化产物的氧化性行回答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) | |
| B. | 0.2 mol•L-1 CH3COONa溶液与0.1 mol•L-1盐酸等体积混合后的酸性溶液中:>c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) | |
| C. | 室温下,向100ml0.5mol/L的Na2CO3溶液中加入0.05molCaO,溶液中增大$\frac{c(O{H}^{-})}{c(H{{C}_{3}}^{-})}$ | |
| D. | 0.1 mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成15.68LN2(标准状况) | |
| B. | 有0.1molKNO3被氧化 | |
| C. | 转移电子的物质的量为0.25mol | |
| D. | 被氧化的N原子的物质的量为1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ 1s22s22p6 | B. | F?1s22s22p6 | C. | N3+ 1s22s22p6 | D. | O 1s22s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 25℃时,Mg(OH)2固体在20mL 0.01mol•L-1氨水中的KSP比在20mL 0.01mol•L-1NH4Cl溶液中的KSP小 | |
| C. | pH试纸测得新制氯水的pH为4.5 | |
| D. | NaHCO3溶液加热蒸干灼烧,得NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L10mol/L浓盐酸与10L水混合 | |
| D. | 10gNaOH固体溶解在水中配成250mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移 | |
| B. | FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| C. | 用浓盐酸酸化KMnO4溶液以增强其氧化性 | |
| D. | 在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | cbadef | B. | dacfbe | C. | badcfe | D. | cbadfe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
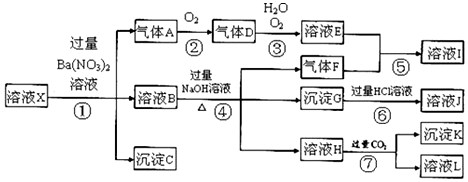
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com