

| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
分析 由图可知,区域3属于氧化还原反应,但不属于置换反应,也不属于化合反应和分解反应,有元素化合价变化的反应为氧化还原反应,单质与化合物反应生成单质与化合物的反应为置换反应,以此来解答.
解答 解:A.属于置换反应,也属于氧化还原反应,故A不选;
B.C、Fe元素的化合价变化,属于氧化还原反应,但不属于置换反应,故B选;
C.属于化合反应,且元素的化合价没有变化,不属于氧化还原反应,故C不选;
D.属于分解反应,且元素的化合价没有变化,不属于氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应及四种基本反应类型,明确反应的分类及反应中元素的化合价变化是解答本题的关键,题目难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
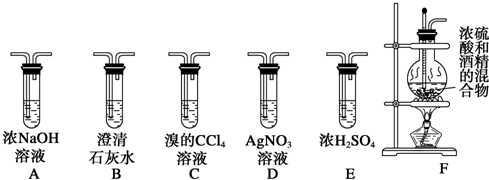
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、SO2都是酸性氧化物 | |
| B. | 盐类物质一定含有金属离子 | |
| C. | H2O、HCOOH、(NH4)2Fe(SO4)2中均含有氧元素,都是氧化物 | |
| D. | 凡能电离出H+的化合物均属酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | B. | BaCl2+Na2SO4═BaSO4↓2NaCl | ||
| C. | BaCl2+H2SO4═BaSO4↓+2HCl | D. | BaCO3+H2SO4═BaSO4↓+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 爆炸力极强的N5变成N2是化学变化 | |
| B. | 水晶、玛瑙、钻石的主要成分均为SiO2 | |
| C. | NaCl溶液和Fe(OH)3胶体可以用过滤的方法分离 | |
| D. | 向鸡蛋清溶液中加入(NH4)2SO4或CuSO4均有鸡蛋清析出,其原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
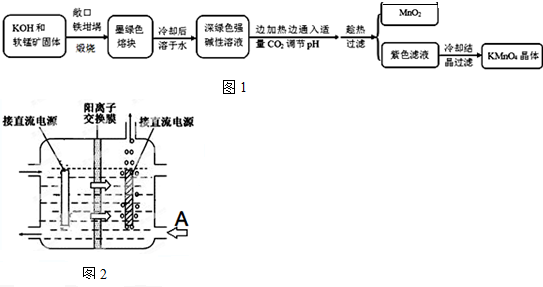
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com