
 通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )| A. | 阴极区溶液pH减小 | |
| B. | 当有6.72LO2(标况下)产生时转移的电子数为1.2mol | |
| C. | 电解时,生成乙烯的电极反应式是:2CO2+12e-+12H+=C2H4+4H2O | |
| D. | 该技术中能量转化方式主要有太阳能转化为电极及电能转化为化学能 |
分析 根据装置图氢离子的移动方向,则左边为阴极,发生得电子的还原反应,生成乙烯反应式为2CO2+12e-+12H+=C2H4+4H2O,右边为阳极,发生失电子的氧化反应,反应式为4OH--4e-=2H2O+O2↑,该技术中能量转化方式主要有太阳能转化为电能,再转变为化学能,据此分析判断.
解答 解:根据装置图氢离子的移动方向,则左边为阴极,发生得电子的还原反应,生成乙烯反应式为2CO2+12e-+12H+=C2H4+4H2O,右边为阳极,发生失电子的氧化反应,反应式为4OH--4e-=2H2O+O2↑,
A、左边为阴极,发生得电子的还原反应,反应式为2CO2+12e-+12H+=C2H4+4H2O,消耗氢离子,所以pH增大,故A错误;
B、右边为阳极,发生失电子的氧化反应,反应式为4OH--4e-=2H2O+O2↑,所以有6.72LO2(标况下)产生时转移的电子数为$\frac{6.72L}{22.4L/mol}$×4=1.2mol,故B正确;
C、电解时,左边为阴极,发生得电子的还原反应,生成乙烯反应式为2CO2+12e-+12H+=C2H4+4H2O,故C正确;
D、由装置得,该技术中能量转化方式主要有太阳能转化为电能,再转变为化学能,故D正确;
故选A.
点评 本题考查电解池知识,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,注意把握常电极反应的书写,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
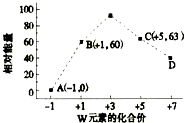 已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:
已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
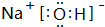 、
、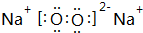 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验器材(省略夹持装置) | 相应实验 | |
| A | 烧杯、锥形瓶、试管、温度计 | 探究温度对H2SO4和Na2S2O3反应速率的影响 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶、电子天平 | 用固体氯化钠配制100mL0.5mol•L-1的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
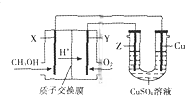 用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )
用甲醇燃料电池电解硫酸铜溶液的装置如图所示,其中X、Y、Z均为惰性电极.甲醇在燃料电池的X电极上产生质子:CH3OH+H2O-e-→CO2+H+(未配平)经质子交换膜到达Y电极;电解一段时间后,在U型管的溶液汇总加入0.1molCu2(OH)2CO3,反应后恰好恢复为电解前的硫酸铜溶液.则下列有关说法正确的是( )| A. | Y为燃料电池的正极,其电极反应为:O2+2H2O+4e-═4OH- | |
| B. | 此电解过程中,Z电极上的反应始终为:2H2O-4e-═4H++O2↑ | |
| C. | 电解过程中中铜电极不会被溶解,其原理为牺牲阳极的阴极保护法 | |
| D. | 电子沿着X→Cu→Z→Y路径移动,每个电极均通过0.6mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
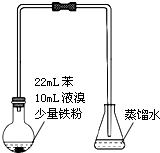 溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.
溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.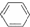 +Br2$\stackrel{铁屑}{→}$
+Br2$\stackrel{铁屑}{→}$ +HBr
+HBr| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗涤除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 检验溶液中的Fe2+离子 | 向溶液中先加入KSCN溶液,再加入氯水 |
| B | 除去Na2SO4溶液中的Na2SO3 | 向混合液中加入适量稀盐酸 |
| C | 用豆浆做豆腐 | 向煮沸的豆浆中加入盐卤(含NaCl、MgCl2、CaCl2等)溶液 |
| D | 排除SO42-对Cl-检验的干扰 | 向混合液中加入过量的Ba(NO3)2溶液,过滤后再取滤液进行检验 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粒子半径:Al3+>Mg2+>Na+ | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2CO3<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH) 2>NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com