
 甲醚(CH3OCH3)被称为21试剂的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21试剂的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.分析 (1)依据燃烧热概念含义是1mol甲醚完全燃烧生成稳定氧化物二氧化碳和液态水放出的热量为燃烧热,结合书写方法写出热化学方程式;
依据燃烧热写出热化学方程式,结合盖斯定律计算得到所需热化学方程式和对应焓变;
(2)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断.
②根据反应放热,故升高温度,平衡左移,据此判断CH3OCH3的产率和混合气体的平均式量M=$\frac{m}{n}$;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,原电池反应比直接燃烧能量转化率高;
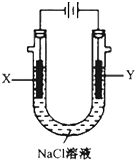
(4)惰性电极电解饱和食盐水,Y电极是阳极,溶液中氯离子失电子生成氯气;依据原电池和电解池中存在的电子守恒结合电极反应计算溶液PH.
解答 解:(1)甲醚的燃烧热为1455kJ/mol,则燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
H2(g)和C(s)的燃烧热分别是285.8kJ•mol-1、393.5kJ•mol-1;热化学方程式:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;
②C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol;
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
依据盖斯定律计算①×3+②×2-③得到反应热化学方程式为:2C(s)+3H2(g)+$\frac{1}{2}$O2(g)═CH2OCH3(g):△H=-169.4kJ/mol;
4C(s)+6H2(g)+O2(g)═2CH2OCH3(g):△H=-338.8kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;△H=-378.8kJ/mol;
(2)①A、在反应达平衡前,c(H2)与c(H2O)的比值在变小,故当c(H2)与c(H2O)的比值保持不变时,反应达平衡,故A选;
B、单位时间内有2mol H2消耗时一定会有1mol H2O生成,故不能作为平衡的标志,故B不选;
C、本反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量一直不变,而又是恒容的容器,即气体体积不变,故气体密度ρ=$\frac{m}{n}$一直不变,故密度不变不能作为平衡的标志,故C不选;
D、此反应是个气体的物质的量有改变的反应,即在平衡之前,容器中气体的物质的量和压强在变化,故当压强不变时,说明反应达平衡,故D选.
故选AD;
②反应放热,故升高温度,平衡左移,故CH3OCH3的产率将变小;本反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量m一直不变,而升温后平衡左移,气体的物质的量变大,故混合气体的平均式量M=$\frac{m}{n}$变小,故答案为:变小;变小;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O;故答案为:CH3OCH3+16OH-12e-=2CO2-3+11H2O;
(4)电解池中Y电极为阳极,溶液中氯离子失电子发生氧化反应生成氯气,现象是冒气泡,上部溶液呈黄绿色;
当燃料电池消耗2.8LO2(标准状况下)物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,电极反应为O2+2H2O+4e-=4OH-,电子转移为0.5mol,电解池中 阳极电极反应为4OH--4e-=2H2O+O2↑,依据电子守恒溶液中减少氢氧根离子物质的量和增加的氢离子物质的量守恒,则溶液中氢离子浓度=$\frac{0.5mol}{0.5L}$=1mol/L,此时NaCl溶液的pH=14;
故答案为:Y电极附近溶液中有气体产生,上部分呈黄绿色;14.
点评 本题考查了热化学方程式的书写方法和燃烧热概念,盖斯定律的计算应用,原电池反应、电解池反应原理的应用判断,掌握实质是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾和硫酸铁均可用作净水剂 | |
| B. | 有单质参加的化学反应一定是氧化还原反应 | |
| C. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| D. | 相同质量的铝粉,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之比是1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
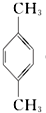 (PX)+12MnO${\;}_{4}^{-}$+36H+→5
(PX)+12MnO${\;}_{4}^{-}$+36H+→5 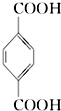 (PTA)+12Mn2++28H2O,下列有关说法错误的是( )
(PTA)+12Mn2++28H2O,下列有关说法错误的是( )| A. | PTA 是该反应的氧化产物 | |
| B. | PTA 与乙二醇通过加聚反应即可生产 PET 塑料 | |
| C. | PX 分子含有苯环的同分异构体还有 3 种 | |
| D. | 该反应消耗 1molPX,共转移 12N A 个电子 ( NA 为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是共价化合物 | |
| B. | SiO2可用于制光导纤维,干冰可用于人工降雨 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | 都是酸性氧化物,都能与强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
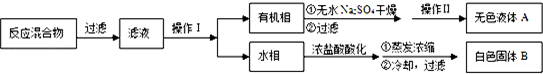
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶 解,冷却、过滤 | 得到白色晶体和无色溶液 | ----------------- |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:E>F>C>D | |
| B. | 分子AC2中各原子最外层均满足8电子结构 | |
| C. | 由D、F组成的盐溶液蒸干后可以得到原溶质 | |
| D. | 元素B的最高价氧化物对应的水化物与其氢化物可以反应生成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
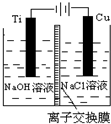 纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
纳米级Cu2O由于具有优良的催化性能而受到关注.采用离子交换膜控制阳极电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )| A. | 钛(Ti)电极表面发生氧化反应 | |
| B. | 阳极附近溶液的pH逐渐减小 | |
| C. | 离子交换膜宜采用阴离子交换膜 | |
| D. | 阳极表面总反应式是:2Cu+2OH--2e-═Cu2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
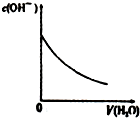 | 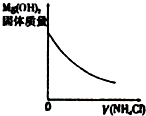 | 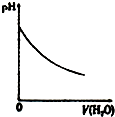 | 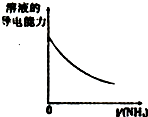 |
| A、盐酸加水稀释 | B、Mg(OH)2悬浊液中滴加NH4Cl溶液 | C、NH4Cl稀溶液加水稀释 | D、NH3通入醋酸溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:5 | C. | 1:10 | D. | 1:8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com