
【题目】无水FeCl3呈棕红色,极易潮解, 100 ℃ 左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
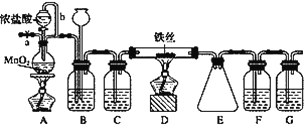
(1)装置A中反应的离子方程式为____________________________________________。
(2)装置F中所加的试剂为________。
(3)导管b的作用为________________________________________________________;
装置B的作用为__________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为______________________________。
(5)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入____________, ___________(填试剂名称和现象)。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 浓硫酸(或浓H2SO4) 平衡压强(或使浓盐酸顺利流下) 除去Cl2中的HCl气体,判断实验过程中导管是否被产品堵塞 排尽实验装置中的空气 KSCN溶液 溶液变红
Mn2++Cl2↑+2H2O 浓硫酸(或浓H2SO4) 平衡压强(或使浓盐酸顺利流下) 除去Cl2中的HCl气体,判断实验过程中导管是否被产品堵塞 排尽实验装置中的空气 KSCN溶液 溶液变红
【解析】
根据实验装置图可知,用浓盐酸与二氧化锰反应生成氯气,氯气中有氯化氢和水杂质,为制备并收集无水FeCl3,B装置中装饱和食盐水,除去氯气中的氯化氢,通过装置中的长颈漏斗可判断实验过程中导管是否被产品堵塞,C装置中装浓硫酸干燥氯气,D装置中铁与氯气反应生成氯化铁,E装置收集生成的氯化铁,实验尾气中有氯气,要用氢氧化钠溶液吸收,由于无水FeCl3极易潮解,所以在收集装置和尾气吸收装置之间加一个干燥装置,防止吸收装置中的水份与氯化铁反应,所以F中装浓硫酸,G中装氢氧化钠溶液,实验时由于装置中有空气中的水蒸气,会与氯化铁反应,所以要先排除装置中的空气,据此答题。
(1)加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应的化学方程式为4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑,故离子方程式为MnO2+4H++2Cl-
MnCl2+2H2O+Cl2↑,故离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)根据上面的分析可知,FeCl3极易潮解,气体必须干燥,装置F中所加的试剂为浓硫酸或浓H2SO4。
(3)根据装置图可知,导管b的作用为平衡压强(或使浓盐酸顺利流下),装置B的作用为除去Cl2中的HCl气体,通过装置中的长颈漏斗可判断实验过程中导管是否被产品堵塞,即装置B的作用为除去Cl2中的HCl气体,判断实验过程中导管是否被产品堵塞;
(4)根据上面的分析可知,若先点燃D处酒精灯,铁丝会与装置中的空气反应,实验时应先排尽实验装置中的空气,所以实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯;
(5)为检验所得产品中是否含有FeCl3,可使用KSCN溶液,当溶液变红可证明产品中含有FeCl3,即试剂名称和现象分别是KSCN溶液、溶液变红。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
回答下列问题:
(1)已知△H1=﹣99kJ·mol﹣1,已知△H2=﹣58kJ·mol﹣1,则△H3=______kJ·mol﹣1。
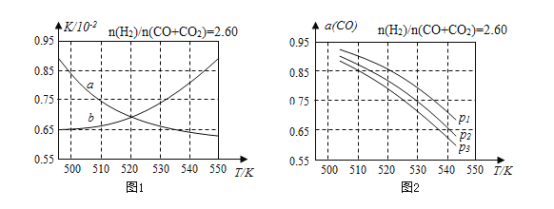
(2)反应①的化学平衡常数K的表达式为______;图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而________(填“增大”或“减小”)图2中的压强由大到小为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①N2(g)+O2(g)=2NO(g) ΔH=180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ· mol-1
③2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ· mol-1
若某反应Ⅰ的平衡常数表达式为K=![]() 请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
(2)一定温度下,向体积为V L的密闭容器中充入一定量的NO和CO,发生反应Ⅰ。
①下列说法正确的是____。
A 当容器内气体压强不再发生变化时,说明反应已达到平衡状态
B 当v(CO2)=v(CO)时,说明反应已达到平衡状态
C 达到平衡后,若向容器中再充入一定量NO,则NO转化率将减小
D 达到平衡后,若再升高温度,由于逆反应速率增大,正反应速率减小,因此平衡向逆反应方向移动
②若反应在t1时刻达到平衡状态,在其他条件不变的情况下,t2时刻通过缩小容器体积使压强增大到原来的2倍,t3时刻达到新的平衡状态。请在图中补充画出t2~t4时段c(NO)的变化曲线: ____

(3)分离高炉煤气得到的CO与空气可设计成燃料电池而除去(以KOH溶液为电解质溶液)。写出该电池的负极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )

A. 图中C点铝元素存在形式是AlO2—
B. 向D点溶液中通人C02气体,立即产生白色沉淀
C. 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
D. OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N![]() N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
A.全部B.①③④⑤C.②③④⑤⑦D.①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
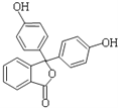
A. 核磁共振氢谱中有5个峰
B. 最多有14个碳原子共平面
C. 可能发生缩聚反应生成高分子化合物
D. 1mol该物质最多能与含4molNaOH的烧碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图的使用说法正确的是
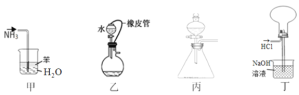
A.甲装置吸收 NH3制氨水
B.乙装置需添加其它仪器才能检验其气密性
C.丙装置中,向酸性高锰酸钾溶液中滴加草酸溶液,溶液的紫红色逐渐褪去
D.丁装置收集并吸收多余的 HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+ 3B(g)![]() 2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( )
2C(g) + 2D(g)在四种不同情况下的反应速率分别为①v(A)= 0.15 mol/(L·s)②v(B)=0.6 mol/(L·s) ③v(C)=0.5 mol/(L·s)④v(D)=0.45 mol/(L·s)。下列表示该反应进行由快到慢的顺序正确的是( )
A.②③④①B.④③②①C.③④②①D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,A、B、C含有相同元素甲,可以发生如下转化(水参与的反应,水未标出)。
![]()
下列说法不正确的是
A.若A、B、C的焰色反应呈黄色、水溶液均呈碱性,则X可以是CO2
B.若C为红棕色气体,则A一定为空气中含量最高的气体
C.若B为FeCl3,则X一定是Fe
D.A可以是碳单质,也可以是O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com