
| 9.6g |
| 64g/mol |
| 0.896L |
| 22.4L/mol |
|
|
| 1 |
| 3 |
| n |
| V |
| 0.448L |
| 22.4L/mol |
| 1 |
| 3 |
| 0.05mol×8 |
| 3 |
| 9.6g |
| 64g/mol |
| 0.896L |
| 22.4L/mol |
|
|
| 0.03mol |
| 0.03mol+0.01mol |
| 1 |
| 3 |
| n |
| V |
| 1.14mol |
| 0.1mol |
| 0.448L |
| 22.4L/mol |
| 1 |
| 3 |
| 0.05mol×8 |
| 3 |
| 0.1mol-0.02mol |
| 2 |
| 25 |
| 3 |
| 25 |
| 3 |
| 25 |
| 3 |
| 25 |
| 3 |


科目:高中化学 来源: 题型:
| A、液态硫酸不导电,硫酸是非电解质 |
| B、NaHSO4在熔融状态下电离产生Na+和HSO4-两种离子 |
| C、溶于水后能导电的化合物一定是电解质 |
| D、电解质在电流的作用下电离产生离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
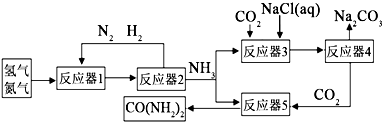
| ||
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
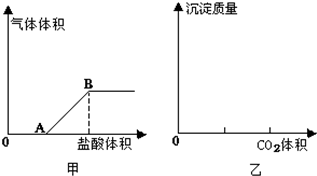
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某溶液中加入盐酸酸化的BaCl2溶液 | 白色沉淀 | 溶液中一定含有SO42- |
| B | 用激光笔照射鸡蛋白溶液 | 有丁达尔效应 | 鸡蛋白溶液属于胶体 |
| C | 某气体通入酸性KMnO4溶液中 | 紫色褪去 | 该气体一定是SO2 |
| D | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无K+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②③ |
| C、②⑦ | D、④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
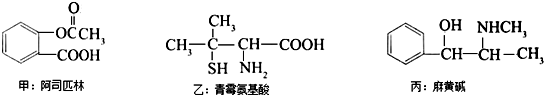
| A、都能发生酯化反应 |
| B、都能与NaOH反应 |
| C、甲的苯环上的一氯代物有4种 |
| D、丙的分子式为C10H15ON,苯环上的一氯代物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰 |
| B、小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| C、节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| D、青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com