
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含 等)制备碱式硫酸铝
等)制备碱式硫酸铝
[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫。

(1) (填“能”或“不能”)用NaOH溶液代替H2SO4溶液。
(2)酸浸时反应的离子方程式为 。
(3)加CaCO3调节溶液的pH至3.6其目的是 。
(4)已知粉煤灰中Al2O3的质量分数为40.8%,制得的碱式硫酸铝[Al2(SO4)x(OH)6-2x]中x=1.5。某实验小组取80.0g粉煤灰进行上述实验,假设在整个过程中铝的损耗率为10%,则可制得碱式硫酸铝的质量为 。
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷
B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3
D.油脂在酸性或碱性条件下均可发生水解反应,且产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
阿司匹林的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:

操作流程如下:

已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是 。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式 。
(3)粗产品提纯:
① 分批用少量饱和NaHCO3溶解粗产品,目的是 。判断该过程结束的方法是 。
② 滤液缓慢加入浓盐酸中,看到的现象是 。
③ 检验最终产品中是否含有水杨酸的化学方法是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):Ⅰ.称取阿司匹林样品m g;
Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式: 。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
近两年来,“雾霾”一直是人们所关注的对象,下图为雾霾的主要成分示意图。下列说法不正确的是( )
 A.SO2和NxOy溶于水均只生成酸
A.SO2和NxOy溶于水均只生成酸
B.重金属离子可导致蛋白质变性
C.苯是最简单的芳香烃
D.大量燃烧化石燃料时造成雾霾天气的一种重要因素
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法不正确的是( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子.在a g HmX中所
含质子的物质的量是 ( )
A. (A-N+m) mol B.
(A-N+m) mol B. (A-N) mol
(A-N) mol
C. (A-N) mol D.
(A-N) mol D.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是________,违反了洪特规则的是________。
①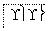

 ②
②

 ③
③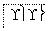



④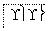
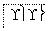
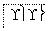
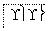
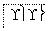 ⑤
⑤




(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。
(3)用符号“>”、“<”或“=”表示下列各项关系。
①第一电离能:Na________Mg,Mg________Ca。
②电负性:O________F,F________Cl。
③能量高低:ns________(n+1)s,ns________np。
④主族序数________价电子数________元素最高正化合价。
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下表:
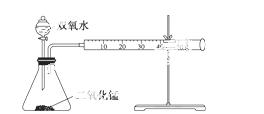
| MnO2时间H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 1 | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
分析表中数据回答下列问题:
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,
理由是_____________________________________________________________________________。
(提示:H2O2的密度可认为近似相等)。
查看答案和解析>>
科目:高中化学 来源: 题型:
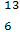 C-NMR(核磁共振)可用于含碳化合物的结构分析。下列有关
C-NMR(核磁共振)可用于含碳化合物的结构分析。下列有关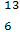 C的说法正确的是 ( )
C的说法正确的是 ( )
A.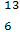 C的质量数是13,原子序数是6,核内有6个中子
C的质量数是13,原子序数是6,核内有6个中子
B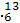 C与金刚石、石墨、C60等互为同素异形体
C与金刚石、石墨、C60等互为同素异形体
C.碳元素的相对原子质量为13
D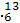 C是碳的一种核素,与
C是碳的一种核素,与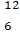 C互为同位素
C互为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com