
【题目】农业对化肥的需求是合成氨工业发展的持久推动力。
(1)氮原子最外电子层上有________种能量不同的电子,其原子核外存在________对自旋相反的电子。
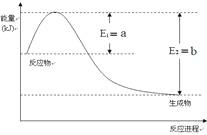
(2)一定温度、压强下,氮气和氢气反应生成1mol氨气的过程中能量变化示意图如右,请写出该反应的热化学反应方程式:_____________。(Q的数值用含字母a、b的代数式表示)
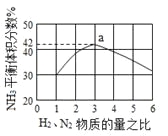
下图表示500℃、60.0MPa条件下,原料气H2和N2的投料比与平衡时NH3体积分数的关系。
(3)工业上合成氨的温度一般控制在500℃,原因是____________________。
根据图中a点数据计算N2的平衡体积分数为__________。
(4)硫化铵晶体与晶体硅相比较,____________的熔点较高,原因是___________。
(5)写出等物质的量浓度等体积的硫酸氢钠与硫化铵溶液反应的离子方程________________。
【答案】2 2 N2(g)+3H2(g)![]() 2NH3(g)+2(b — a)mol 该温度下催化剂的活性最好 14.5% 晶体硅 它属于原子晶体,而硫化铵属于离子晶体 H++S2-→HS-
2NH3(g)+2(b — a)mol 该温度下催化剂的活性最好 14.5% 晶体硅 它属于原子晶体,而硫化铵属于离子晶体 H++S2-→HS-
【解析】
(1)氮原子核外电子数为7,基态原子核外电子排布为1S22S22P3,故最外层电子排布式为2S22P3;不同能级上的电子具有不同的能量,故氮原子核外最外层有2种不同能量的电子;原子核外轨道式如图所示![]()
![]() ,1S和2S能级上存在2对自旋相反的电子。
,1S和2S能级上存在2对自旋相反的电子。
(2)反应为放热反应,Q=b-a,反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)+2(b — a)mol。
2NH3(g)+2(b — a)mol。
(3)N2+3H22NH3该反应是放热的可逆反应,要使平衡向正反应方向移动,应降低温度,但温度过低反应速率过小,不利于工业生成效益;温度越高,反应速率越大,所以应适当升高温度,使反应速率增大;使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度;依据反应特征
N2+3H2=2NH3 △V
1 3 2 2
平衡体积V V
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142×![]() =35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为14.5%;
=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为14.5%;
(4)晶体类型不同,熔点有差异。晶体硅属于原子晶体,而硫化铵属于离子晶体,所以硅的熔点较高;
(5)NaHSO4 = Na++ H++ SO42- , (NH4)2S 电离生成的S2-在酸性溶液中生成HS-,故离子方程式为:H++S2- =HS-;


科目:高中化学 来源: 题型:
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/LNaOH溶液中加入0.2 mol/LHN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法不正确的是( )
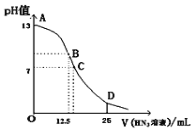
A.该滴定过程中应用酚酞作指示剂
B.若B点pH=8,则c(HN3)=(10-6-10-8 )mol/L
C.点D对应溶液中存在关系:c(N3-)>c(Na+)>c(HN3)
D.沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素及其化合物广泛存在于自然界中,请回答下列问题:
Ⅰ![]() 锗
锗![]() 是典型的半导体元素,在电子、材料等领域应用广泛。
是典型的半导体元素,在电子、材料等领域应用广泛。
![]() 基态Ge原子的核外电子排布式为
基态Ge原子的核外电子排布式为![]() ______。
______。
![]() 与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因可能是______。
与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因可能是______。
![]() 比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因
比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因
|
|
| |
熔点 |
| 26 | 146 |
沸点 |
| 186 | 约400 |
![]() 光催化还原
光催化还原![]() 制备
制备![]() 的反应中,带状纳米
的反应中,带状纳米![]() 是该反应的良好催化剂。Zn、Ge、O的电负性由大至小的顺序是______。Ⅱ
是该反应的良好催化剂。Zn、Ge、O的电负性由大至小的顺序是______。Ⅱ![]() 碳元素的単质有多种形式,其化合物在电子、材料等领域亦应用广泛。
碳元素的単质有多种形式,其化合物在电子、材料等领域亦应用广泛。
![]() 下图所示依次是
下图所示依次是![]() 、石墨和金刚石的结构图。金刚石、石墨烯
、石墨和金刚石的结构图。金刚石、石墨烯![]() 指单层石墨
指单层石墨![]() 中碳原子的杂化形式分别为______、______。
中碳原子的杂化形式分别为______、______。
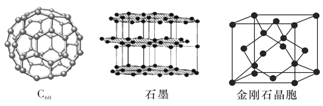
![]() 属于______晶体,石墨属于______晶体。
属于______晶体,石墨属于______晶体。
![]() 一种含碳磁性材料的单晶胞结构如图所示。
一种含碳磁性材料的单晶胞结构如图所示。
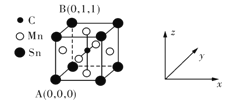
![]() 原子坐标参数表示晶胞内部各原子的相对位置。上图所示晶胞结构中A的原子坐标参数为
原子坐标参数表示晶胞内部各原子的相对位置。上图所示晶胞结构中A的原子坐标参数为![]() 0,
0,![]() ,B为
,B为![]() 1,
1,![]() ,则该晶胞中碳原子的原子坐标为______。
,则该晶胞中碳原子的原子坐标为______。
![]() 在晶体中的堆积方式为______
在晶体中的堆积方式为______![]() 填“简单立方”“体心立方”“面心立方最密”或”六方最密”
填“简单立方”“体心立方”“面心立方最密”或”六方最密”![]() 堆积。
堆积。
![]() 若该晶胞的边长为apm,
若该晶胞的边长为apm,![]() 表示阿伏加德罗常数的值,则该晶体密度的表达式为______。
表示阿伏加德罗常数的值,则该晶体密度的表达式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是一种检验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
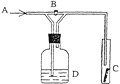
A.浓H2SO4 B.饱和食盐水C.浓NaOH溶液D.KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现将足量的AgCl固体分别放入下列液体中,AgCl的溶解度由大到小排列的顺序正确的是( )
①20mL 0.1molL-1(NH4)2CO3溶液 ②40mL 0.03molL-1 HCl溶液 ③50mL 0.05molL-1 AgNO 3 溶液 ④30mL 0.02molL-1 CaCl 2 溶液 ⑤10mL蒸馏水 ⑥30mL 0.02molL-1 NH4NO3溶液
A.②>③>④>⑥>⑤>①B.①>⑥>⑤>②>④>③
C.①>②>③>④>⑤>⑥D.③>②>④>⑥>①>⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氧、氮、镁、铬、铁、锌是几种重要的元素,请回答下列问题:
![]() 铝的基态原子的价电子排布式是_________________。
铝的基态原子的价电子排布式是_________________。
![]() 用水解法制备一种磁性材料铁氧体时常加入尿素
用水解法制备一种磁性材料铁氧体时常加入尿素![]() 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________,分子中
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________,分子中![]() 键和
键和![]() 键的数目之比为__________。醋酸钠中碳原子的杂化类型为____________。
键的数目之比为__________。醋酸钠中碳原子的杂化类型为____________。
![]() 、
、![]() 等金属离子与
等金属离子与![]() 、
、![]() 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,其原因是__________;已知氨
,其原因是__________;已知氨![]() 熔点:
熔点:![]() 、沸点:
、沸点:![]() ,联氨
,联氨![]() 熔点:
熔点:![]() 、沸点:
、沸点:![]() ,解释其熔沸点高低的主要原因:______________。
,解释其熔沸点高低的主要原因:______________。
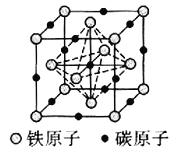
![]() 碳溶解在
碳溶解在![]() 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________。若晶体密度为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________。若晶体密度为![]() ,则晶胞中最近的两个碳原子的距离为__________
,则晶胞中最近的两个碳原子的距离为__________![]() 阿伏加德罗常数的值用
阿伏加德罗常数的值用![]() 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
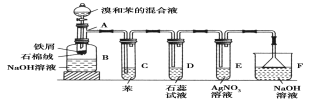
请填写下列空白:
①试管C中苯的作用是:______________________。
反应开始后,观察D和E两试管,看到的现象为:___________________。
②反应2~3min后,在B中的NaOH溶液里可观察到的现象是______________。
③在上述整套装置中,具有防倒吸的仪器有________(填字母)。
(2)实验室制备硝基苯的主要步骤如下:
a.配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
b.向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
c.在55℃~60℃下发生反应,直至反应结束;
d.除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏水洗涤;
e.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯。
请填写下列空白:
①配制一定比例的浓H2SO4和浓HNO3的混合酸时,操作的注意事项是________。
②步骤d中洗涤、分离粗硝基苯应使用的仪器是________________。
③步骤d中粗产品用5% NaOH溶液洗涤的目的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是解决化学分析问题的常用方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.如图为某浓度的NaOH溶液滴定10.00mL一定浓度的盐酸的示意图。根据图像

(1)HCl溶液的浓度是__________;NaOH溶液的浓度是_______;
(2)x=________。
(3)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。


ΙΙ.氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。
(4)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度,抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
①滴定时,盛放高锰酸钾溶液的仪器名称为_________确定反应达到终点的现象_____________。
②草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO42-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据所给数据计算血液样品中Ca2+离子的浓度为__________mg/cm3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com