
t℃,22.0%的NaNO3(aq)150 mL,加100 g水稀释后浓度变为14.0%,则原溶液的物质的量浓度是________.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
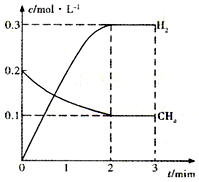 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
| n(CH4) |
| n(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验 序号 |
体积V/ml | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |

| △H1-△H2 |
| 2 |
| △H1-△H2 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| n |
| 3 |
| n |
| 3 |
| V/s | 0 | 50 | 100 |
| c(N2O3)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
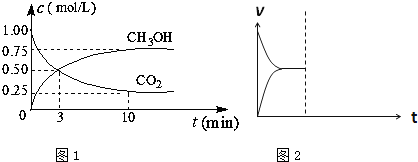
| 催化剂 |
| 温度/k CO2转化率% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
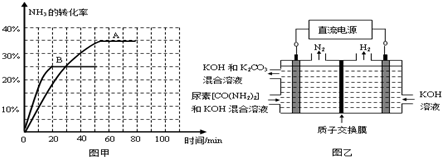
| 一定条件 |
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com