
����Ŀ���ڻ���ƽ�����װ�л�ԭ����(N2H4)��ǿ������H2O2�������ǻ��ʱ�������������ĵĵ�����ˮ���������ų���������������֪0.4molҺ̬�º�����˫��ˮ��Ӧ���ɵ�����ˮ����ʱ�ų�256.65KJ��������
��1��д���º�������Ľṹʽ��_______����������_________��
��2��������ӦӦ���ڻ���ƽ��������ͷų����������Ϳ��ٲ������������⣬����һ����ͻ�����ŵ���______��
��3��д���º�˫��ˮ��Ӧ���Ȼ�ѧ����ʽ___________��
��4����֪H2O��l���TH2O��g������H=+44KJ/mol����16gҺ̬��������˫��ˮ��Ӧ���ɵ�����Һ̬ˮʱ���ų���������_________��
��5����֪��
N2��g��+2O2��g��=2NO2��g����H=+67.7kJ/mol
N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-543kJ/mol
������NO2��ȫ��Ӧ���Ȼ�ѧ����ʽΪ________��
���𰸡� ![]() H-O-O-H ����Ϊ������ˮ������Ⱦ N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.6kJ/mol 408.8kJ 2N2H4��g��+2NO2��g���T3N2��g��+4H2O��g����H=-1135.7KJ/mol
H-O-O-H ����Ϊ������ˮ������Ⱦ N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.6kJ/mol 408.8kJ 2N2H4��g��+2NO2��g���T3N2��g��+4H2O��g����H=-1135.7KJ/mol
����������1��N2H4��Nԭ��֮���γ�1�Թ��õ��Ӷԣ�Nԭ��Hԭ�������γ�1�Թ��õ��Ӷԣ��ṹʽΪ![]() ��H2O2��Oԭ��֮���γ�1�Թ��õ��Ӷԣ�Oԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ��ṹʽΪH-O-O-H�� ��2������N2H4����H2O2��Ӧ������Ϊ������ˮ������Ⱦ��ͻ�����ŵ��ǣ�����Ϊ������ˮ������Ⱦ����3��0.4molҺ̬�º�����˫��ˮ��Ӧ���ɵ�����ˮ����ʱ�ų�256.65KJ��������1molҺ̬�·ų�������Ϊ
��H2O2��Oԭ��֮���γ�1�Թ��õ��Ӷԣ�Oԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ��ṹʽΪH-O-O-H�� ��2������N2H4����H2O2��Ӧ������Ϊ������ˮ������Ⱦ��ͻ�����ŵ��ǣ�����Ϊ������ˮ������Ⱦ����3��0.4molҺ̬�º�����˫��ˮ��Ӧ���ɵ�����ˮ����ʱ�ų�256.65KJ��������1molҺ̬�·ų�������Ϊ![]() =641.625kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.625kJ/mol����4����֪����N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.625kJ/mol����H2O��l���TH2O��g����H=+44KJ/mol�����ݸ�˹���ɣ���-����4��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-817.625kJ/mol��16gҺ̬�µ����ʵ���Ϊ
=641.625kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.625kJ/mol����4����֪����N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.625kJ/mol����H2O��l���TH2O��g����H=+44KJ/mol�����ݸ�˹���ɣ���-����4��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-817.625kJ/mol��16gҺ̬�µ����ʵ���Ϊ ![]() =0.5mol����ȫ��Ӧ����Һ̬ˮʱ�ų�������Ϊ0.5mol��817.625kJ/mol=408.8kJ����5����֪����N2 ��g��+2O2��g��=2NO2 ��g����H1=+67.7kJ/mol������N2H4��g��+O2 ��g��=N2��g��+2H2O ��g����H2=-543kJ/mol
=0.5mol����ȫ��Ӧ����Һ̬ˮʱ�ų�������Ϊ0.5mol��817.625kJ/mol=408.8kJ����5����֪����N2 ��g��+2O2��g��=2NO2 ��g����H1=+67.7kJ/mol������N2H4��g��+O2 ��g��=N2��g��+2H2O ��g����H2=-543kJ/mol
���ݸ�˹���ɣ����2-���2N2H4��g��+2NO2��g���T3N2��g��+4H2O��g����H=2��H2-��H1=-1153.7KJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ǿ����ʵĻ����Һ10L�����п��ܺ�K+��Ba2+��Na+��NH4+��Cl��SO42��AlO2��OH�еļ��֣�������ͨ��CO2���壬������������������CO2����֮�ʵĹ�ϵ��ͼ��ʾ���ش��������⣺
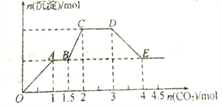
��1������Һ����ȷ�����ڵ�������____________________;
��2�� �϶������ڵ�������___________;
��3�� ������ȷ�������������ٻ�����һ�������ӣ�����������ӵķ�����____________;
������ӵ�Ũ��Ϊ _________;
��4��CD�η�Ӧ�����ӷ���ʽ__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƣ�Na3N���ǿ�ѧ���Ʊ���һ����Ҫ�Ļ��������ˮ���ÿɲ���NH3 �� ��ش��������⣺
��1��Na3N�ĵ���ʽ�� �� �û����������γɣ�
��2��Na3N�����ᷴӦ�������Σ������ʽ�ֱ��� �� ��
��3��Na3N��ˮ�ķ�Ӧ�������������Ӧ���ͣ���Ӧ��
��4���Ƚ�Na3N���������ӵİ뾶��r��Na+�����������=���������� r��N3������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
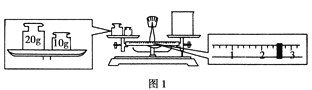
����Ŀ����1��ijͬѧ��������ƽ�����ձ�����������ƽƽ����״̬��ͼ1��ʾ����ͼ�п��Կ�������ͬѧ�ڲ���ʱ��һ��������___________________���ձ���ʵ������Ϊ__________ g��
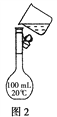
��2��������150 mL 0.2 mol��L��1 NaCl��Һ����ͬѧת����Һ��ʾ��ͼ��ͼ2��ʾ��ָ��ʵ���д��ڵ���������_________________________________��
��3������������Ϊ98%�ܶ�Ϊ1.84 g��cm��3��Ũ��������1 000 mL 0.1 mol��L��1��ϡ���ᡣ
��Ӧ����Ͳ��ȡŨ����________ mL��
����������ʱ���õ�����������Ͳ��С�ձ�����������_______________________��
�����в���ʹ��������Һ�����ʵ���Ũ��ƫ�ߵ���________(�����)��
A������ʱ������������� B����NaOH����ֽ���ϳ���
C������ʱ���ӿ̶��� D��������ƿ��ת��ʱ��������Һ�彦��
E��δϴ���ܽ�NaOH���ձ� F������ʱ���ӿ̶���
G������ƿδ���T����������ҺH�����ݺ�����ƿ������ҡ�ȣ����ú�Һ�治���̶��ߣ��ټ�ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�ֻ���зǼ��Թ��ۼ����ǣ� ��
A��NaOH B��NaCl C��H2S D��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ̽��Ԫ�����ڱ���Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�飮
��1���ٽ��ơ��ء�þ������1mol�ֱ�Ͷ�뵽������ͬŨ�ȵ������У���Ԥ��ʵ�����������ᷴӦ����ң������ᷴӦ������������࣮
����Na2S��Һ��ͨ���������ֻ�ɫ���ǣ���֤��Cl�ķǽ����Ա�S ǿ����Ӧ�����ӷ���ʽΪ ��
��2��������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯���� 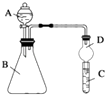
������B������Ϊ �� �����D������Ϊ ��
����Ҫ֤���ǽ����ԣ�Cl��I����A�м�Ũ���ᣬB�м�KMnO4��KMnO4��Ũ���᳣���·�Ӧ������������C�мӵ��۵⻯�ػ����Һ���۲쵽C��������֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�������Һ����β����
����Ҫ֤���ǽ����ԣ�N��C��Si������A�м���B�м�̼��ơ�C�м���Һ�۲쵽C����Һ��������֤����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̫ƽ����ͼ��ַ����жԾ��������������¼���:�����������Ƚ��������ۻ���֭����������ȥ�ң��Ժþ�һ��������ʯ���������ۣ��������������䣬�����Ը���ȡ�����á��������漰�IJ��������ǣ� ��
A. ���� B. ���� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʹ��������ƽ������������ȷ����
A. ����ǰ�ȵ���������ƽ�����
B. ����ʱ���̷ű���������̷�����
C. ��ʪ�Ļ���и�ʴ�Ե�ҩƷ��������ڲ����������������������ҩƷ��ֱ�ӷ�����ƽ�����ϳ���
D. ��������ƽ����ȷ������0.1 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ṥҵ�����У�Ϊ��������SO2��ת�������ܳ���������ܣ��������м����Ƚ������ĽӴ��ң�����ͼ��������˵���������
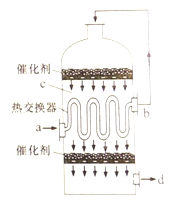
A. a��b�����Ļ������ɷֺ�����ͬ���¶Ȳ�ͬ
B. c��d�����Ļ������ɷֺ�����ͬ���¶Ȳ�ͬ
C. �Ƚ�������������Ԥ�ȴ���Ӧ�����壬��ȴ��Ӧ�������
D. c�����徭�Ƚ������ٴδ�������Ŀ�������SO2��ת����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com