
【题目】A、B、C、D、E、X、F是周期表中前四周期的七种元素,它们的原子序数依次增大。A元素的核外电子数和电子层数相等,是宇宙中最丰富的元素。B的最外层电子数为其内层电子数的2倍,D基态原子的s能级和p能级上电子数相等,E在短周期元素中第一电离能最小,X与D同主族,F在周期表的第八列。
(1)基态F原子的核外有_______种运动状态的电子。基态F3+的最外层电子排布式是________。
(2)B、C、D三种元素的电负性由大到小的排列是_______(填元素符号)。
(3)A、B、D形成BA2D型分子,该分子的空间构型为________。
(4)BC-中B原子的杂化轨道类型是_______,该离子中含有的σ键与π键的数目之比为_____。写出一种与该分子互为等电子体的单质分子的结构式_______。
(5)E2X与E2D相比较熔点较高的是______(填化学式),原因是__________。
(6)奧氏体是B溶解在F中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为_______。若晶体密度为dg.cm-3,则晶胞中最近的两个B原子的距离为______pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
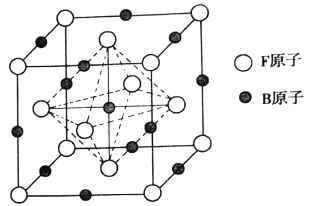
【答案】 26 3s23p63d5 O N C 平面三角形 sp 1:2 N≡N Na2O 氧化钠跟硫化钠都是离子晶体,氧离子的半径小于硫离子,氧化钠晶格能大,所以氧化钠的熔点高 FeC ![]()
【解析】A、B、C、D、E、X、F是周期表中前四周期的七种元素,它们的原子序数依次增大。A元素的核外电子数和电子层数相等,是宇宙中最丰富的元素,A为H元素。B的最外层电子数为其内层电子数的2倍,B为C元素;D基态原子的s能级和p能级上电子数相等,D为O元素,则C为N元素;E在短周期元素中第一电离能最小,E为Na元素;X与D同主族,X为S元素;F在周期表的第八列,F为Fe元素。
(1)Fe为26号元素,基态铁原子有26种运动状态的电子。基态Fe3+的最外层电子排布式是3s23p63d5,故答案为:3s23p63d5;
(2)元素的非金属性越强,电负性数值越大,B、C、D三种元素的电负性由大到小的排列是O>N>C,故答案为:O>N>C;
(3)A、B、D形成CH2O型分子为HCHO,碳原子采用sp2杂化,空间构型为平面三角形,故答案为:平面三角形;
(4)CN-与氮气互为等电子体,C原子的杂化轨道类型是sp,该离子中含有的σ键与π键的数目之比为1:2,氮气的结构式为N≡N,故答案为:sp;1:2;N≡N;
(5)氧化钠跟硫化钠都是离子晶体,氧离子的半径小于硫离子,氧化钠晶格能大,所以氧化钠的熔点高,故答案为:Na2O;氧化钠跟硫化钠都是离子晶体,氧离子的半径小于硫离子,氧化钠晶格能大,所以氧化钠的熔点高;
(4)晶胞结构分析可知一个晶胞中含铁原子8×![]() +6×
+6×![]() =4,碳原子12×
=4,碳原子12×![]() +1=4,化学式中铁原子和碳原子比为1;1,化学式为FeC;一个晶胞中含4个FeC,晶胞中最近的两个碳原子的距离设为x,立方体棱边的一半为a,则2a2=x2,a=
+1=4,化学式中铁原子和碳原子比为1;1,化学式为FeC;一个晶胞中含4个FeC,晶胞中最近的两个碳原子的距离设为x,立方体棱边的一半为a,则2a2=x2,a=![]() ,密度d=
,密度d=![]() =
= ![]() =
=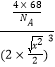 ,x=
,x=![]() ×
×![]() cm═
cm═![]() ×
×![]() ×1010pm,故答案为:FeC;
×1010pm,故答案为:FeC;![]() ×
×![]() ×1010。
×1010。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】科学家研发出了一种新材料,其工作原理如图所示。在外接电源作用下,材料内部发生氧化还原反应导致颜色变化,从而实现对光的透过率进行可逆性调节。已知WO3和Li4Fe4[Fe(CN6]3均为无色透明,LiWO3和Fe4[Fe(CN6]3均有颜色。下列说法正确的是( )
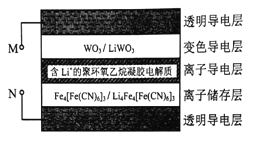
A. 当M外接电源正极时,该材料颜色变深使光的透过率降低
B. 该材料在使用较长时间后,离子导电层中Li+的量变小
C. 当M外接电源负极时,离子导电层中的Li+向变色导电层定向迁移
D. 当N外接电源正极时,离子储存层的电极反应式为:Fe4[Fe(CN6]3+4Li++4eˉ= Li4Fe4[Fe(CN6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液。
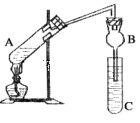
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
(1)浓硫酸的作用是________________________________。
(2)球形管B除起冷凝作用外,另一重要作用是____________________________。
(3)反应中所用的乙醇是过量的,其目的是___________________。
(4)C中饱和碳酸钠溶液的作用__________________________________________。
(5)从C中分离出乙酸乙酯必须使用的一种仪器是______________________;分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__________,再加入无水硫酸钠,然后进行蒸馏,收集77℃的馏分,以得到较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A.1:2
B.1:4
C.3:4
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如表:
元素 | 相 关 信 息 |
A | 原子核外有7种运动状态不同的电子 |
B | 外围电子排布式为nsnnpn+2 |
C | 常见的金属,在周期表中周期序数与族序数相等 |
D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
E | 一种核素的质量数为56,中子数为30 |
F | 单质紫红色,电缆材料,常见氧化物为黑色 |
回答下列问题:
(1)元素E在元素周期表中的位于第四周期第族,其高价态离子核外有个未成对电子
(2)B、C、D三种元素的离子半径由小到大的顺序是(用离子符号表示).
(3)A,D两元素的简单氢化物发生反应生成的化合物的电子式为
(4)常温下AD3是一种淡黄色液体.以下关于AD3的说法中,正确的是
A.AD3分子中只有非极性键
B.AD3分子中各原子均达8e﹣稳定结构
C.AD3的晶体属于分子晶体
D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是;该过程总的离子反应式为向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是 A.配位键 B.极性共价键 C.非极性共价键 D.离子键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法不正确的是( )
A.除去Na2CO3固体中少量NaHCO3:加热
B.除去CO2中少量SO2:通过饱和NaHCO3溶液
C.除去氯气中少量氯化氢:通过氢氧化钠溶液
D.除去氧化铁中少量氧化铝:加入过量的烧碱溶液后,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.光合作用是将光能转化为化学能的有效途径
B.煤,石油,天然气都是可再生的化石燃料
C.用植物秸秆制沼气是有效利用生物质能的方式之一
D.开发氢能,太阳能,风能,生物质能等是实现“低碳生活”的有效途径
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是25℃时四种酸的电离平衡常数:
化学式 | CH3COOH | HA | HNO2 | H2CO3 |
Ka | Ka=1.8×10﹣5 | Ka=4.9×10﹣10 | Ka=4.6×10﹣4 | Ka1 =4.1×10﹣7 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因
(2)25℃时,向向0.1molL﹣1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO﹣)=5:9,此时溶液pH=
(3)写出NaA溶液中通少量CO2的离子方程式
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2 , 某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法(填“可行”或“不可行”),理由是
(6)已知NaHCO3溶液中存在HCO3H++CO32﹣ , 加水稀释时溶液中的c(H+)将(填“增大”或“减小”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com