
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)zC(g)。该反应达到平衡后,测得A气体的浓度为0.5 mol·L-1。在恒温下将密闭容器体积扩大到原来的2倍,再次达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是( )
A.平衡向正反应方向移动
B.x+y<z
C.C的体积分数降低
D.B的转化率提高
科目:高中化学 来源: 题型:
在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S) PH3(g) + HI(g) ① ;
4PH3(g) P4(g)+ 6 H2(g) ② ;
2HI(g) H2( g) + I2(g) ③
g) + I2(g) ③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴ 平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)= ,n(PH3)= 。
⑵ a,b,c三者的关系服从a > (填含b,c的代数式)。
⑶ 平衡后,增大压强,容器内n(I2) , n(PH4I) (增加、减少、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的反应,属于同一反应类型的是 ( )
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的鉴别方法不正确的是( )
A.用焰色反应鉴别NaCl、KCl和K2SO4
B.用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液
C.利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液
D.用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种物质之间有如下转化关系:
甲 乙
乙 丙
丙 甲
甲
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是________。写出“乙 丙”转化的离子方程式:________________________________________________。
丙”转化的离子方程式:________________________________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是:________。写出“甲 乙”转化的离子反应方程式:________________________________________________。
乙”转化的离子反应方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一个1 L的密闭容器中放入4 mol N2O5气体后会发生如下两种反应:①N2O5(g)N2O3(g)+O2(g);②N2O3(g)N2O(g)+O2(g)。在某温度下达到平衡后c(O2)=4.4 mol·L-1,c(N2O3)=1.6 mol·L-1。求反应中N2O5的分解率。
查看答案和解析>>
科目:高中化学 来源: 题型:
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-===LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为________ 。
。
(2)写出“正极碱浸”中发生反应的离子方程式__________________。
(3)“酸浸”一般在80 ℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式______________________________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是________________。
(4)写出“沉钴”过程中发生反应的化学方程式_____________。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式__________________________________。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是________________________________。在整个回收工艺中,可回收到的金属化合物有________________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知钍(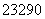 Th)的原子可发生下列放射性变化,
Th)的原子可发生下列放射性变化,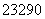 Th→
Th→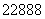 X+
X+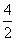 α,生成的X是与钫(Fr)同周期
α,生成的X是与钫(Fr)同周期
的一种元素的原子,下列对X的推断错误的是 ( )
A.X的氢氧化物是一种强碱
B.X的碳酸正盐不溶于水
C.X原子核外有6个电子层
D.X的最高化合价为+2价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com