
| A. | Ca2Mg5Si8O22(OH)2属于硅酸盐 | |
| B. | 昆仑玉是混合物,透闪石中Mg元素与Ca元素的质量比是3:2 | |
| C. | 透闪石的化学式写成氧化物的形式为:2CaO•5MgO•8SiO2•H2O | |
| D. | 透闪石是一种新型无机非金属材料,易溶于水 |
分析 A.硅酸盐指的是硅、氧与其它化学元素 (主要是铝、铁、钙、镁、钾、钠等)结合而成的化合物的总称;
B.根据元素的质量分数=$\frac{所有元素的相对原子质量}{分子的性对分子质量}$来计算;
C.根据元素守恒定律,硅酸盐化学上常用二氧化硅和氧化物的形式表示其组成的方法;
D.新型无机非金属材料主要有先进陶瓷、非晶体材料、人工晶体、无机涂层、无机纤维等.
解答 解:A.Ca2Mg5Si8O22(OH)2是硅、氧与其它化学元素形成的化合物,属于硅酸盐,故A正确;
B.透闪石中Mg元素的质量分数是$\frac{24×5}{透闪石的相对分子质量}$×100%,Ca元素质量分数是$\frac{80}{透闪石的相对分子质量}$,Mg元素的质量分数:Ca元素质量分数=3:2,Mg元素的质量分数是Ca元素质量分数的1.5倍,质量比是3:2,故B正确;
C.硅酸盐改写成氧化物的形式为:活泼金属氧化物•较活泼金属氧化物•SiO2•H2O,同时要遵循原子守恒,Ca2Mg5Si8O22(OH)2写成氧化物形式为:2CaO•5MgO•8SiO2•H2O,故C正确;
D.透闪石不是新型无机非金属材料,故D错误.
故选D.
点评 本题考查硅酸盐的有关知识以及根据题中所给的信息和元素守恒定律定律进行分析解题的能力,难度不大,基础知识的积累.


科目:高中化学 来源: 题型:解答题
 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水、浓H2SO4 | B. | 酸性KMnO4溶液、浓H2SO4 | ||
| C. | 溴水、浓H2SO4 | D. | CCl4、碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 硅胶可用作食品干燥剂 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
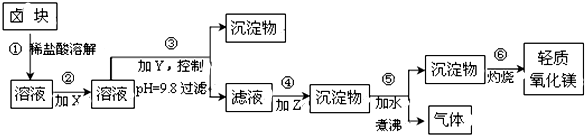
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 水玻璃中加入稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| C. | 在氯化铝溶液中滴加过量的氨水:Al3++3 OH-═Al (OH)3↓ | |
| D. | 大理石与盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
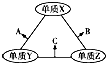 (Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题:
(Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题: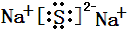 .(用元素符号表示)
.(用元素符号表示)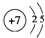 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CHCl3是三角锥形 | B. | AB2是V形,其A可能为sp2杂化 | ||
| C. | 二氧化硅是sp杂化,是非极性分子 | D. | NH4+是平面四边形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的酸性强于次氯酸,判断硫与氯的非金属性强弱 | |
| B. | 镁与铝分别与物质的量浓度相同的盐酸反应,判断镁与铝的金属活动性强弱 | |
| C. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| D. | Cl2与Br2分别与足量的H2反应,判断氯与溴的非金属性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com