
| A. | Ba2+、Fe2+、Cl-、NO3- | B. | CO32-、SO42-、Na+、K+ | ||
| C. | Cl-、MnO4-、OH-、K+ | D. | Mg2+、SO42-、NO3-、Na+ |
分析 强酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.Fe2+、H+、NO3-发生氧化还原反应,不能共存,且Fe2+为浅绿色,与无色不符,故A不选;
B.酸性溶液中不能大量存在CO32-,故B不选;
C.MnO4-为紫色,与无色不符,且MnO4-、H+、Cl-发生氧化还原反应,不能共存,酸性溶液中不能大量存在OH-,故C不选;
D.酸性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故D选;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
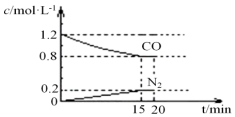 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6gCH4中含有的分子数 | |
| B. | 1molH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下22.4LCO气体中含有的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN浓液 | 有气体生成,溶液未呈红色 | 稀硝酸不能将Fe氧化为Fe3+ |
| B | NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-与HCO3-发生双水解反应 |
| C | 向某溶液里滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变 | 原溶液中无NH4- |
| D | 将0.1mol/LMgSO4溶液滴入NaOH溶液里至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的Ksp小于Mg(OH)2的Ksp |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷不溶于水,能溶于大多数有机溶剂 | |
| B. | 溴乙烷与NaOH的醇溶液共热可生成乙醇 | |
| C. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | 氧化性I2>KClO3 | ||
| C. | 还原性KClO3>I2 | D. | 还原剂为I2,氧化剂为Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com