
 ,过氧化氢
,过氧化氢
分析 (1)肼分子式为NH2-NH2,每个氮原子形成三个化学键,过氧化氢分子式H2O2,每个氧原子形成两个共价键,依据结构写出物质的结构式;
(2)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(3)依据热化学方程式和盖斯定律计算得到热化学方程式,得到反应的焓变;
(4)依据热化学方程式和盖斯定律计算得到热化学方程式.
解答 解:(1)肼分子式为NH2-NH2,每个氮原子形成三个化学键,结构式为: ;过氧化氢分子式H2O2,每个氧原子形成两个共价键,分子结构为:
;过氧化氢分子式H2O2,每个氧原子形成两个共价键,分子结构为: ;
;
故答案为: ;
; ;
;
(2)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量,32g肼燃烧放热641.625kJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
(3)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol,
②H2O(l)═H2O(g)△H=+44kJ/mol;
依据盖斯定律,①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625kJ/mol
则16g液态肼与足量液态过氧化氢反应生成氮气和液态水放热时408.8KJ;
故答案为:408.8KJ;
(4)已知①N2(g)+2O2(g)═2NO2(g);△H=+67.7KJ/mol,
②N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534KJ/mol,
依据盖斯定律②×2-①得到肼与NO2完全反应的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7KJ/mol.
点评 本题考查了化学反应能量变化的计算应用,物质结构分析判断,盖斯定律的计算,热化学方程式书写方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量8.75g食盐 | |
| B. | 用500ml的容量瓶配制480ml溶液 | |
| C. | 用10ml量筒量取6.46ml盐酸 | |
| D. | 用广泛pH试纸测得某溶液的pH为4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
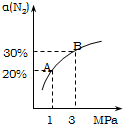 某温度下,对于反应N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ | |
| B. | 平衡状态由A变到B时,平衡常数K(A)<K(B) | |
| C. | 上述反应在达到平衡后,增大压强,H2的转化率提高 | |
| D. | 保持压强不变,通入惰性气体,平衡常数不变,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出1780kJ的能量 | B. | 放出1220kJ的能量 | ||
| C. | 放出450kJ的能量 | D. | 吸收430kJ的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com