
| 沸点/℃ | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |
分析 (1)根据题中数据,采用分馏方法提纯SiHCl3;
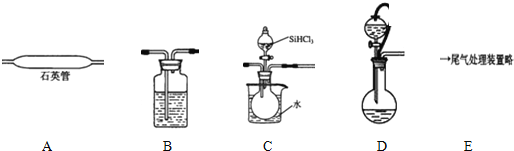
(2)①依据实验目的可知:锌与硫酸制备氢气,干燥干燥后通入用热水浴加热SiHCl3,在石英管中反应生成硅和氯化氢,最后进行尾气处理,据此排序;
装置D中g管连接分液漏斗与烧瓶,起平衡压强的作用;浓硫酸干燥氢气;通过水浴加热使滴入烧瓶中的SiHCl3气化,与氢气混合均匀;
②SiHCl3和氢气反应有硅单质生成,根据硅的颜色判断D装置中的颜色变化;反应温度较高,普通玻璃会软化;SiHCl3和H2反应生成硅和氯化氢;
③氢气是可燃性气体,易产生爆炸,为防止安全事故的发生,所以先通一段时间H2,将装置中的空气排尽;
(3)铁能够与氢氧化剂反应生成三价铁离子,三价铁离子遇到硫氰酸钾显红色,据此检验铁元素的存在.
解答 解:(1)SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),由于沸点差别较大,可以通过分馏除去杂质,
故答案为:分馏;平衡压强;浓硫酸;使滴入烧瓶中的SiHCl3气化;
(2)①依据实验目的可知:锌与硫酸制备氢气,干燥干燥后通入用水冷却的SiHCl3,在石英管中反应生成硅和氯化氢,最后进行尾气处理,所以正确的顺序为DBCAE;
装置D中g管连接分液漏斗与烧瓶,起平衡压强的作用;浓硫酸干燥氢气;通过水浴加热使滴入烧瓶中的SiHCl3气化,与氢气混合均匀;
故答案为:DBCAE;
②高温下,SiHCl3和氢气反应生成硅单质,硅单质是灰黑色固体,所以D装置中的现象是:石英管的内壁附有灰黑色晶体;反应方程式为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,
故答案为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
③氢气是可燃性气体,易产生爆炸,为防止安全事故的发生,所以先通一段时间H2,将装置中的空气排尽,所以应先打开D;
故答案为:D;因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气;
因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气;
(3)铁能够与氢氧化剂反应生成三价铁离子,三价铁离子遇到硫氰酸钾显红色,要检验铁单质的存在可以:先滴加氯水,再滴加硫氰化钾溶液,溶液显红色;
故答案为:先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
点评 本题考查了实验方案设计的有关知识,铁离子的检验,明确实验原理和目的是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
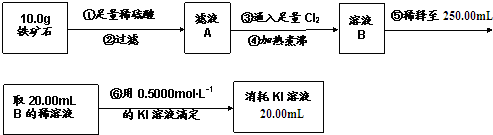
| A. | 步骤④中煮沸的作用是为了除去残留的氯气 | |
| B. | 步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 | |
| C. | 铁矿石中铁的百分含量为56% | |
| D. | 该铁矿石中若含氧为24%,则铁的氧化物的化学式为Fe2O3•3FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的浓度变为0.08mol/L | B. | 阳极上产生112ml O2 (标准状况) | ||
| C. | 转移的电子数是1.204×1022 个 | D. | 反应中有0.01mol Ag 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1mol甲醇完全燃烧时,转移的电子数为6NA | |
| C. | 标准状况下,22.4L甲烷和22.4L氯仿所具有的微粒数均为NA | |
| D. | 1 L 0.1mol/L醋酸溶液中含有的氢离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古代用铜矿石、锡矿石冶炼铸造青铜器 | |
| B. | 出土后的青铜器大多数已受到锈蚀 | |
| C. | 古代用明矾溶液清除青铜镜表面的锈斑 | |
| D. | 现代用双氧水去除青铜器上有害的CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
| B | H2O2 | 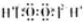 | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H216O和20gH218O含有的质子数均为10 NA | |
| B. | l Ll mol/L的KAl(SO4)2溶液中阳离子总数为2 NA | |
| C. | 0.2 mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3 NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3 molH2同时有2 NA个N-H断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com