
分析 (1)KMnO4固体加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到气体b mol氯气,根据电子转移守恒,整个过程中,元素Mn获得的电子数等于元素O、Cl失去的电子数,则有:0.04x×(7-2)=4a+2b,整理得a+b=0.1x-a.
(2)每生成1mol氧气转移电子数为4mol,每生成1mol氯气转移电子数为2mol,生成的氯气越多总气体量越大,故在高锰酸钾失去电子数一定的情况下生成的氯气量与总气体量成正比.当高锰酸钾没有分解时,生成氧气为0,即a=0,此时生成氯气最多;当高锰酸钾完全分解生成氧气时,生成氧气最多,而生成氯气最少,并根据方程式求算两种极限思想下的气体的量,进而确定(a+b)的最小值;
(3)根据2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑计算出生成的K2MnO4、MnO2和O2以及剩余的KMnO4的物质的量,根据得失电子数相等找出关系式2KMnO4~5Cl2、K2MnO4 ~2Cl2和MnO2 ~Cl2计算氯气的物质的量,最后根据质量守恒计算残留固体的质量.
解答 解:(1)KMnO4固体,加热一段时间后,收集到a mol氧气,在反应后的残留固体中加入足量的浓盐酸,继续加热,收集到b mol氯气,根据电子转移守恒,整个过程中,元素Mn获得的电子数等于元素O、Cl获得的电子数,根据电子守恒得0.04x×(7-2)=4a+2b,整理得a+b=0.1x-a,
故答案为:0.1x-a;
(2)①当高锰酸钾未分解时,氧气生成量a=0,此时氯气生成量最大,故2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2 5
0.04 0.1,则(a+b)=0.1;
②当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.04mol×$\frac{1}{2}$=0.02mol,则(a+b)=0.1-0.02=0.08,故0.08≤a+b≤0.1,故(a+b)的最小值为0.08,
故答案为:0.08;
(3)a+b=0.09mol时,2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
2 1 1 1
0.04x 0.04x 0.04x 0.02x,
根据得失电子数相等找出关系式2KMnO4~5Cl2 K2MnO4 ~2Cl2MnO2 ~Cl2
0.04(1-x) $\frac{5}{2}×0.04×(1-x)$ 0.04x 2×0.04x 0.04x 2×0.04x
得 0.02x+$\frac{5}{2}×0.04×(1-x)$+2×0.04x+2×0.04x=0.09mol,解得x=0.5,
残留固体的质量m=0.04mol×158g/mol-0.02×0.5×32g/mol=6g.
答:残留的固体的质量为6g.
点评 本题考查混合物计算、氧化还原反应计算,难度中等,注意充分利用整个过程中的电子转移守恒解答.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:解答题
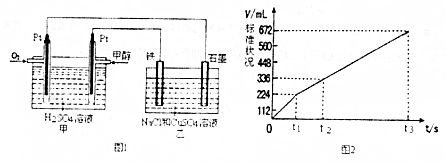
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 反应能量变化 | 放出29.4KJ | 吸收aKJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
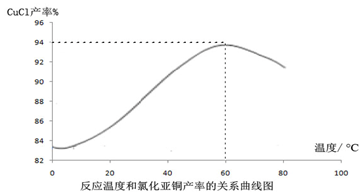
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 51 | B. | 54 | C. | 57 | D. | 60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.
美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.
.该反应中还原剂是KI,21.4g KIO3参加反应时转移电子0.5mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
将铜丝压扁,掰成图案 | 将铅丹、硼酸盐等化合熔制后描绘 | 高温焙烧 | 酸洗去污 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol-NH2(氨基)中所含有的电子数为0.9NA | |
| B. | lmol D218O所含的中子数为12NA | |
| C. | 14 g聚乙烯与聚丙烯的混合物中含H原子的数目为2NA | |
| D. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成的SO3分子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com