
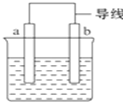
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:分析 (1)Al、Cu、稀硫酸构成的原电池,金属Al作负极,金属Cu为正极,正极上氢离子得到电子,负极上Al失去电子;
(2)Al、Mg、NaOH溶液构成的原电池中,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,以此来解答.
解答 解:(1)Al、Cu、稀硫酸构成的原电池,金属Al作负极,金属Cu为正极,正极上氢离子得到电子,电极反应为:2H++2e-=H2↑,负极上Al失去电子,电极反应为:Al-3e-=Al3+,当电路中有0.2mol e-通过时,反应的Al的物质的量为$\frac{0.2mol}{3}$,则负极Al的质量减少为$\frac{0.2mol}{3}$×27g/mol=1.8g;
故答案为:2H++2e-=H2↑;1.8;
(2)Al、Mg、NaOH溶液可构成原电池,发生电池反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al为负极失去电子,电极反应为:2Al-6e-+8OH-=2AlO2-+4H2O,正极上水中的氢离子得到电子,电极反应为:6H2O+6e-=3H2↑+6OH-,
故答案为:Mg;2Al-6e-+8OH-=2AlO2-+4H2O;6H2O+6e-=3H2↑+6OH-.
点评 本题考查原电池原理,把握图中装置的分析及原电池的工作原理为解答的关键,侧重电解质溶液与电极的反应、转移电子的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=3的溶液中:Na+、NO3-、Cl-、Al3+ | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、ClO-、SO42-、Na+ | |
| C. | 由水电离出的c(H+)=10-13 mol•L-1的溶液中:CO32-、SO42-、Cl-、Na+ | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
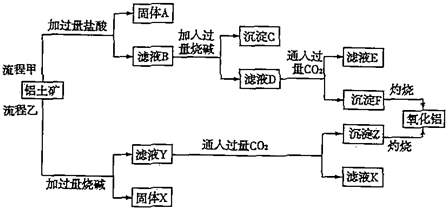
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,据此填写下列空格.
,据此填写下列空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2反应生成1mol H2O释放能量一定为245kJ | |
| D. | 为开发氢能,可研究设法将太阳能聚焦,产生高温使水分解产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com