
某兴趣小组利用如下仪器组装成一套装置,测量电解饱和食盐水后所得混合液的pH和验证氯气的氧化性。
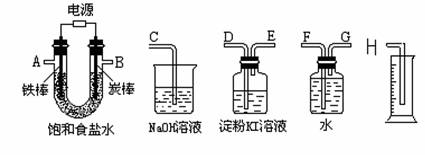
(1)实验时各种仪器接口的连接顺序(填编号)是:A接__________________________,B接__________________________;
(2)炭棒接直流电源的________极,电解总反应方程式是 ;
(3)能证明氯气具有氧化性的实验现象是________________________________;
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电,摇匀U形管内的溶液后溶液的pH约为__________。
科目:高中化学 来源: 题型:阅读理解
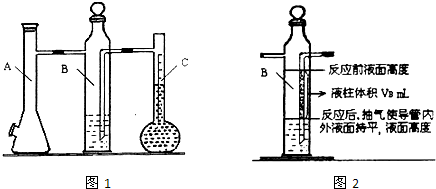
| 实验次数 | m(Mg)/g | 硫酸体积/mL | 液体量瓶中液体体积/mL | 抽出气体体积/mL | 氢气体积/mL | 计算1mol氢体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
| 实验次数 | m(Mg) g |
硫酸体积mL | 液体量瓶中液体体积mL | 抽出气体体积mL | B瓶的一段液柱体积mL | 水汽体积百分含量 | 计算1mol氢体积L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |
查看答案和解析>>
科目:高中化学 来源:江苏省通州市石港中学2008届高三化学科押宝卷 题型:058
某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验.
X溶液是________,滴入的量一般为________.

(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应.在盛有氢氧化钠溶液的试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量.①写出测定溶液pH的方法:_________________________.
②下图中哪个图像符合该同学的记录________(填序号).

(3)你认为甲、乙两位同学的实验中,________(填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:
____________________________________.
Ⅱ.丙同学利用“保温瓶式量热计”(图略),测出10 mL 10% NaOH溶液和不同体积的10%盐酸溶液混合过程中,溶液的温度变化见下表(假设两溶液密度相同).

就此实验回答:
(1)盐酸和氢氧化钠的反应是________(填“吸热”或“放热”)反应.
(2)请在图中绘制出溶液的温度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示.

Ⅲ.丁同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置.实验时先在烧杯中加入20 g 40%的氢氧化钠溶液,再逐滴加入该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系图.

(1)请以此次测定的结果,列式计算该盐酸的实际质量分数.
(2)请分析你的计算结果与标签标示的质量分数不一致的可能原因.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com