
【题目】熔融碳酸盐燃料电池简称MCFC ,具有高发电效率,工作原理示意图如图。下列有关说法正确的是

A. 电极M为负极,K+、Na+移向M
B. 电池工作时,熔融盐中CO32-物质的量增大
C. A 为CO2,正极的电极反应为:O 2+4e -+2CO2 = 2CO32 -
D. 若用MCFC给铅蓄电池充电,电极N接Pb极
【答案】C
【解析】
熔融碳酸盐燃料电池中通入燃料的电极是负极,发生氧化反应,通入氧气的电极是正极,发生还原反应O2+4e-+2CO2=2CO32-,原电池中阳离子移向正极,阴离子移向负极,在充电时,电池的负极连接电源的负极,电池的正极连接电源的正极。
A、熔融碳酸盐燃料电池,通入燃料的电极是负极,通入氧气的电极是正极,电极M 为负极,原电池中阳离子移向正极,即K+、Na+移向N,故A错误;
B、反应的方程式:O2+2H2=2H2O,电池工作时,熔融盐中CO32-物质的量不会改变,故B错误;
C、通入氧气的电极是正极,A 为CO2,发生还原反应O2+4e-+2CO2=2CO32-,故C正确;
D、用MCFC给铅蓄电池充电,电池的负极连接电源的负极,电极N接PbO2极,故D错误。
故选C。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成的溶液,可以发生如图转化,下列说法正确的是
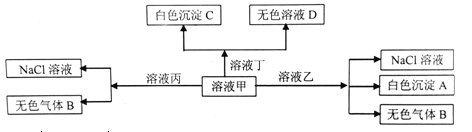
A. 甲为HCl,乙为NaHCO3
B. 溶液丙中还可以大量共存的离子有:Fe2+、NO3-、SO42-
C. 在甲中滴加丁开始反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O
D. 白色沉淀A可能溶解在溶液D中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:
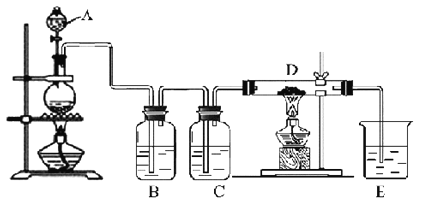
(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对液态有机物M进行如下探究实验。请回答:
Ⅰ.M组成的探究
取6.2 g有机物M在足量O2中完全燃烧后,将生成 物全部通入如图1所示装置(夹持装置略去),则:
(1)若不考虑尾气处理,该装置还有一个明显不足为____________________________。
(2)若不考虑其他因素,且生成物在A、B中全部被吸收,测得装置A增重5.4 g,装置B增重8.8 g,M的实验式为___________________,分子式为_______________________。
Ⅱ.M结构的探究
为确定M的官能团,该小组设计如图2所示装置(加持装置略)进行实验,步骤为:
①准确量取2.79 mL ρ=1.11 g·mL-1的M加入分液漏斗中;
②打开分液漏斗活塞,当M恰好全部加入a中时,迅速关闭分液漏斗活塞;
③a中反应完全后,准确读取量筒中液体体积。
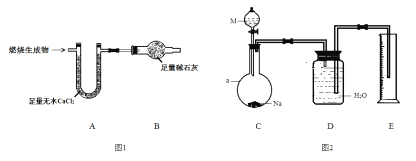
(3)a仪器的名称为__________;伸入量筒中的导管 ____(填“长”或“短”)些更合理。
(4)实验前,检验C、D部分装置气密性的方法为____________________________。
(5)第③步中,准确读取量筒读数,注意的事项为冷至室温、__________________和_____________________________。
(6)下列各项,可能导致所测气体体积偏大的为__________(填选项字母)。
A.所取M中含有少量水
B.装置C中Na过量
C.装置D、E间导管中的水没有排入量筒中
D.分液漏斗中液体M加入仪器a,将a中部分气体排入D
(7)若量筒中水的体积转化为标准状况下气体体积为560 mL,装置C中反应的化学方程式为______________________________________________(有机物用结构简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
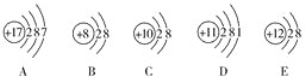
①与离子相对应的元素符号是______________,与原子相对应的离子的结构示意图是______________。
②电子层结构相同的是__________(填写代号,下同),性质最稳定的是__________,最容易失去电子的是__________,最容易得到电子的是__________。
③可直接相互结合形成的化合物的化学式是____________。可经过得失电子后再相互结合形成的化合物的化学式是______________。
④在核电荷数1~10的元素内,列举两个与B电子层结构相同的离子,写出离子的符号______________。
(2)已知元素X和Y的核电荷数均小于18,最外层电子数分别为n和(m-5),次外层有(n+2)个和m个电子,据此推断元素X和Y,其名称为X__________,Y__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则下列说法正确的是( )
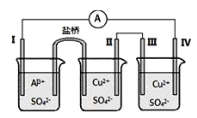
A.电流方向:电极IV→![]() →电极I
→电极I
B.电极I失电子,发生还原反应
C.电极II逐渐溶解
D.电极III的电极反应:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有位于前四周期的A、B、C、D、E、F六种元素,它们的核电荷数依次增大。其中C、E、F是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。F元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
(1)A是_____,B是_____,F是_____。(写元素符号)
(2)写出F元素基态原子的核外价电子排布图_____,其最高化合价为_____。
(3)含E元素的化合物灼烧的颜色是_____。很多金属盐都可以发生焰色反应,其原因是_____。
(4)请写出元素C的最高价氧化物对应的水化物与HClO4反应的离子方程式:_____。
(5)C与E的金属性强弱关系是C____E,请设计一个简单实验来证明:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:
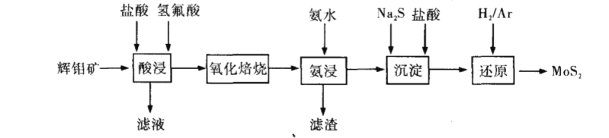
回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数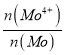 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com