
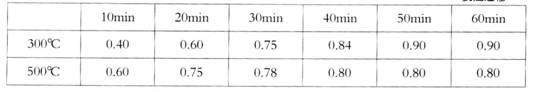
| 10min | 20min | 30min | 40min | 50min | 60min | |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
 ,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母).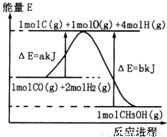
 ,压强增大,平衡正向移动,以此分析.
,压强增大,平衡正向移动,以此分析.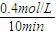 =0.04mol/(L?min),由速率之比等于化学计量数之比可知氢气的反应速率为0.04mol/(L?min)×2=0.08mol/(L?min),故答案为:0.08mol/(L?min);
=0.04mol/(L?min),由速率之比等于化学计量数之比可知氢气的反应速率为0.04mol/(L?min)×2=0.08mol/(L?min),故答案为:0.08mol/(L?min); =25,故答案为:25;
=25,故答案为:25; ,压强增大,平衡正向移动,
,压强增大,平衡正向移动,

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段:
(2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段:| 10min | 20min | 30min | 40min | 50min | 60min | |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:
甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:| 10min | 20min | 30min | 40min | 50min | 60min | |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)甲醇合成反应为:CO(g)+2H2(g) CH3OH(g)
工业上用天然气为原料,分为两阶段制备甲醇:
(1)制备合成气:CH4+H2O(g) CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
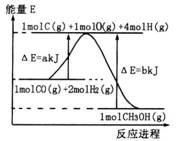
(2)合成甲醇:①反应过程中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
实验室在1L密闭容器中进行模拟合成实验。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:
(表中数据单位:mol·L—1)
②300℃时反应开始10分钟内,H2的平均反应速率为__________。
③500℃时平衡常数K的数值为___________。
④300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系 产生的影响是__________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省泰安市高三上学期期末检测化学试卷 题型:填空题
(10分)甲醇合成反应为:CO(g)+2H2(g) 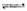 CH3OH(g)
CH3OH(g)
工业上用天然气为原料,分为两阶段制备甲醇:
(1)制备合成气:CH4+H2O(g)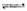 CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
CO+3H2。为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO3+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为____________________________________。
(2)合成甲醇:①反应过程中物质能量变化如右图所示。写出合成甲醇的热化学方程式__________________。
实验室在1L密闭容器中进行模拟合成实验。将lmolCO和2molH2通人容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:
(表中数据单位:mol·L—1)
 ②300℃时反应开始10分钟内,H2的平均反应速率为__________。
②300℃时反应开始10分钟内,H2的平均反应速率为__________。
③500℃时平衡常数K的数值为___________。
④300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系 产生的影响是__________(填字母)。
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加 d.重新平衡时c(H2)/c(CH3OH)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com