
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9m~10-7m之间 | |
| B. | 用平行光照射NaCl溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液与NaOH溶液混合,以制取Fe(OH)3胶体 | |
| D. | 除去Fe(OH)3胶体中的H+、Cl-,可用渗析的实验方法 |
分析 A、胶体区别于其他分散系的本质特征是分散质的微粒直径;
B、丁达尔效应是胶体所特有的性质;
C、氯化铁饱和溶液和氢氧化钠反应生成氢氧化铁沉淀;
D、胶体不能通过半透膜.
解答 解:A、胶体区别于其他分散系的本质特征是分散质的微粒直径,胶体的分散质的微粒直径在10-9 m-10-7m之间,故A正确;
B、丁达尔效应是胶体所特有的性质,溶液没有,故可以用丁达尔效应来区分溶液和胶体,故B正确;
C、氯化铁饱和溶液和氢氧化钠反应生成氢氧化铁沉淀,而不是胶体,故C错误;
D、胶体不能通过半透膜,小离子或分子可以通过,故D正确.
故选C.
点评 本题考查了胶体的有关性质,应注意的是丁达尔效应是胶体所特有的性质,但不是胶体的本质特征.


科目:高中化学 来源: 题型:实验题
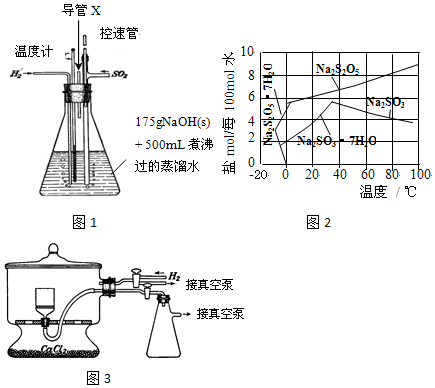
 亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:
亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g水含有的原子数为NA | |
| B. | 4g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1molO2的质量等于1mol氧原子的质量 | |
| D. | 24gO2和24gO3所含的原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②中水的电离程度的是①的8倍 | |
| B. | ①和③中水的电离程度相等 | |
| C. | 等体积的①和④混合后所得溶液中:c(NH3•H2O)<c(NH4+) | |
| D. | ②中水的电离程度等于④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com