
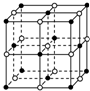
 食盐晶体是由钠离子(图中的“
食盐晶体是由钠离子(图中的“ ”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )
”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列.已知食盐的密度是2.2g•cm-3,阿伏加德罗常数6.02×1023 mol-1.在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( )| A. | 3.0×10-8 cm | B. | 3.5×10-8 cm | C. | 4.0×10-8 cm | D. | 5.0×10-8 cm |
分析 根据晶胞结构图可知,每个晶胞中有钠离子$8×\frac{1}{8}+6×\frac{1}{2}$=4个,氯离子1+12×$\frac{1}{4}$=4个,根据$ρ=\frac{m}{V}$计算出晶胞的体积,进而求得晶胞的边长,在食盐晶体中两个距离最近的钠离子中心间的距离为晶胞面对角线的一半,据此计算.
解答 解:根据晶胞结构图可知,每个晶胞中有钠离子$8×\frac{1}{8}+6×\frac{1}{2}$=4个,氯离子1+12×$\frac{1}{4}$=4个,根据$ρ=\frac{m}{V}$可计算出晶胞的体积为$\frac{\frac{4×58.5}{6.02×1{0}^{23}}}{2.2}$cm3=1.77×10-22cm3,所以晶胞的边长为5.61×10-8cm,所以晶胞的碳对角线长为$\sqrt{2}×$5.61×10-8cm=8.0×10-8 cm,在食盐晶体中两个距离最近的钠离子中心间的距离为晶胞面对角线的一半,所以两个距离最近的钠离子中心间的距离为4.0×10-8 cm,
故选:C.
点评 本题关键是利用阿佛加德罗常数求解出分子的体积,然后根据分子的立方体模型列式估算分子间距,中等难度.


科目:高中化学 来源: 题型:选择题
| A. | 22.4 L | B. | 2.24 L | C. | 44.8 L | D. | 4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.04mol/(L•s) | ||
| C. | v(C)=0.03mol/(L•s) | D. | v(D)=0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
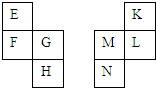 E~N等元素在周期表中的相对位置如下表.E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是( )
E~N等元素在周期表中的相对位置如下表.E与K的原子序数相差4,K的一种单质是空气中含量最多的物质,H与N属同周期元素,下列判断不正确的是( )| A. | 原子半径:M>L>K | |
| B. | F的单质与氧气反应只生成一种氧化物 | |
| C. | H与N的原子核外电子数相差14 | |
| D. | 最高价氧化物的水化物酸性:K>L>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 机身隔框一般采用超硬铝,承受较大载荷的加强框采用高强度结构钢或钛合金 | |
| B. | 航空发动机对材料的要求非常高,所以其气缸必须使用纯度相当高的金属材料 | |
| C. | 很多飞机的机载雷达装在机身头部,一般采用玻璃纤维增强塑料做成的头锥将机身头部罩住以便能透过电磁波 | |
| D. | 采用特殊的新型复合材料作为表面涂层,使其几乎不反射雷达所发出的电磁波,雷达就检测不到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| B. | 0.1 L 3 mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com