
【题目】下列各組中的反应,属于同一反应类型的是
A. 乙醛与氧气制乙酸;苯与氢气制环已烷
B. 葡萄糖与新制银氨溶液共热;蔗糖与稀硫酸共热
C. 丙酮与氢气反应制2-丙醇;乙烯与氯化氯反应制氯乙烷
D. 乙醇与乙酸制乙酸乙酯;溴乙烷与氢氧化钠醇溶液制乙烯
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系。下列有关物质的推断不正确的是
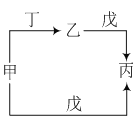
A.若甲为Na,则戊可能是H2O
B.若甲为C2H4,则戊可能是O2
C.若甲为NO,则戊可能是H2O
D.若甲为Cl2,则戊可能是NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是

A.图甲为在水溶液中H+和OH-的浓度变化曲线,恒温稀释可实现a→b的转化
B.图乙为H2O2在有、无催化剂下的分解反应曲线b表示有催化剂时的反应
C.图丙可表示用0.0110mol/L盐酸滴定0.0110mol/L氨水时的滴定曲线
D.图丁为NaCl中混有少量KNO3,除去KNO3可在较高温度下制得浓溶液再冷却结晶、过滤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
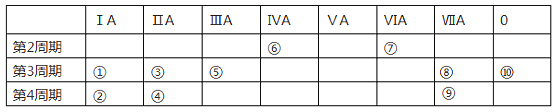
(1)10种元素中,化学性质最不活泼的是________________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是____________。
(4)元素⑦的氢化物常温下和元素⑧的单质反应的化学方程式为:____________。
(5)①和⑨两种元素形成化合物的化学式为_________,该化合物溶液与元素⑧的单质反应的化学方程式为_______________。
(6)已知元素的电负性与元素的化合价一样,也是J已索的一种基本性质。下面给出14种元素的电负性。
元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2 | 1.5 | 2.5 | 2.8 | 4 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,推测元素的电负性的变化规律是:_________,_________。
(2)预测Br与I元素电负性的大小关系_________,前四周期中,电负性最小的元素是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为回收利用废钒催化剂(含有V205、V0S04及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质常温时在水中的溶解性如下:

回答下列问题:
(1)废钒催化剂,粉碎的目的是 ,V0S04溶液水解显酸性,离子方程式为
(2)工业上由V2O5冶炼金属钒常用铝热法,该反应的化学方程式为 引发铝热反应的操作是:在纸漏斗中加入铝热剂后,再
(3)为了提高钒的浸出率,反应①用Na2SO3和硫酸酸浸使催化剂中的V2O5转变成可溶于水的V0S04,与水浸液合并,再通过反应②用KClO3氧化,使+4价的V氧化成易溶于水的(VO2)2SO4反应①的离子方程式为
(4)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为 。
(5)已知常温下NH4VO3的溶解度为0.468g/100g水,则NH4VO3的溶度积常数约为 (已知V的相对原子质量为51)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014福建)元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
① 完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
② II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。
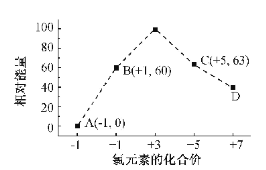
① D是 (填离子符号)。
② B→A+C反应的热化学方程式为 (用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com