
| 实验 | 预期现象和结论 |
| 取少许吸收液于试管中滴加1~2滴0.01mol•L-1KMnO4溶液 | 若溶液褪色则假设1成立,否则假设1不成立 |
分析 (1)氢氧化钠过量,二氧化硫和氢氧化钠反应生成亚硫酸钠和水;
(2)吸收尾气(Cl2)一段时间后,根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH- 和SO42-.①可假设1、溶液中可能存在只存在SO32,2、既不存在SO32-也不存在ClO-,3、SO32-、ClO-都存在或者只存在ClO-; ②3mol•L-1H2SO4硫酸电离生成氢离子,溶液显酸性,次氯酸根离子具有漂白性,亚硫酸根离子具有强的还原性,能被酸性的高锰酸钾氧化而使高锰酸钾褪色,选择具有强氧化性高锰酸钾溶液,证明SO32-的存在.
解答 解:(1)SO2与过量NaOH溶液反应,因NaOH过量,故生成的是正盐,化学方程式为:SO2+2NaOH=Na2SO3+H2O,离子方程式为:SO2+2OH-=H2O+SO32-,
故答案为:SO2+2OH-=H2O+SO32-;
(2)吸收尾气(Cl2)一段时间后,根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,氯化钠、硫酸钠都为强电解质完全电离,所以吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH- 和SO42-,
故答案为:Cl-、SO42-;
①可假设1、溶液中可能存在只存在SO32,2、既不存在SO32-也不存在ClO-,3、SO32-、ClO-都存在或者只存在ClO-;
故答案为:两种离子都存在(或者只存在ClO-);
②因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL-L-1 H2SO4至溶液呈酸性,若存在SO32-,生成了H2SO3,H2SO3具有还原性,选择具有强氧化性高锰酸钾溶液,
在试管中滴加0.01mol•L-1KMnO4溶液1~2滴,若紫红色褪去,证明有SO32-,否则无,
故答案为:
| 实验 | 预期现象和结论 |
| 取少许吸收液于试管中滴加1~2滴0.01mol•L-1KMnO4溶液 | 若溶液褪色则假设1成立,否则假设1不成立 |
点评 本题属于实验探究题,要根据实验原理提出假设,再利用物质的性质加以验证,明确物质的性质是解题关键,(2)题为难点,注意依据反应产物的性质设计实验,利用亚硫酸的还原性验证是否含有亚硫酸根离子,题目难度中等.


科目:高中化学 来源: 题型:填空题
 +CaCl2+H2O
+CaCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族金属元素是同周期中金属性最强的元素 | |
| B. | 非金属元素组成的化合物中只含共价键 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | VIIA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 3mol/L 的X溶液 | B. | 20mL 2mol/L 的X溶液 | ||
| C. | 10mL 4mol/L的X溶液 | D. | 10mL 2mol/L的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O. +Br2→
+Br2→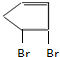 、
、 +Br2→
+Br2→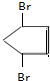 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当12NA个电子转移时,该反应放出1411 kJ的能量 | |
| B. | 当2NA个水分子生成且为液体时,放出1411 kJ的能量 | |
| C. | 当8NA个碳氧共用电子对生成时,放出1411 kJ的能量 | |
| D. | 当8NA个碳氧双键生成时,放出1411 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X的分子式为C12H16O3 | |
| B. | 可用酸性高锰酸钾溶液区分苯和X | |
| C. | X在一定条件下能发生水解、酯化、加成等反应 | |
| D. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com