
【题目】钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
(4)一种钛镍合金的立方晶胞结构如图所示:

①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
【答案】 1s22S22p63s23p63d24s2或[Ar] 3d24s2 第4周期第VIII族 正四面体 sp3 产生白色沉淀 [Co (NH3)5SO4]Br 6 ![]() ×1010 或
×1010 或![]() ×103
×103
【解析】(1) Ti原子序数为22,其基态![]() 原子的电子排布式为1s22S22p63s23p63d24s2,或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族。
原子的电子排布式为1s22S22p63s23p63d24s2,或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族。
(2) 阴离子是SO2-4;根据价层电子对互斥理论可知价层电子对数为4,属于sp3 杂化,为正四面体构型。
(3)往其溶液中加BaCl2溶液,有白色沉淀,所以该物质为[Co(NH3)5Br]SO4;另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,该配合物能电离出Br-,则其化学式为:[Co(NH3)5SO4]Br。
(4)①根据晶胞可以看出,每个Ti原子周围距离最近的Ni原子有6个,所以Ti的配位数为6。
②此晶体属于面心立方晶型,每个晶胞中含有4个Ti原子,根据ρ=m/V进行计算。
(1) Ti原子序数为22,其基态![]() 原子的电子排布式为1s22S22p63s23p63d24s2或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族;正确答案:1s22s22p63s23d24s2或[Ar] 3d24s2 ;第4周期第VIII族。
原子的电子排布式为1s22S22p63s23p63d24s2或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族;正确答案:1s22s22p63s23d24s2或[Ar] 3d24s2 ;第4周期第VIII族。
(2) Ti(SO4)2、NiSO4中,阴离子是SO2-4;根据价层电子对互斥理论可知价层电子对数为(6+2)/2=4,则中心原子S原子为sp3 杂化,其空间立体构型是正四面体;正确答案:正四面体;sp3。
(3) 一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液,发生反应Ba2++SO42-=BaSO4↓,产生白色沉淀;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,该配合物能电离出Br-,则其化学式为:[Co (NH3)5SO4]Br ;正确答案:产生白色沉淀;[Co (NH3)5SO4]Br 。
(4)①根据晶胞可以看出,每个Ti原子周围距离最近的Ni原子有6个,所以Ti的配位数为6;正确答案:6。
②由晶胞可知,此晶体属于面心立方晶型,而且Ti占据晶胞的顶点和面心,Ni占据晶胞的棱心和体心,则每个晶胞中含有1/4×12+1=4个Ni原子和1/2×6+1/8×8=4个Ti原子,设晶胞晶胞边长apm,则有一个晶胞的质量为(a×10-10)3×d=4×107/NAg,解得a3=![]() ×1030,a=
×1030,a=![]() ×1010 pm 或
×1010 pm 或![]() ×103 pm;正确答案:
×103 pm;正确答案:![]() ×1010 或
×1010 或![]() ×103。
×103。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为NA
B. 1molNaHSO4在熔融状态下电离出的阳离子数为2NA
C. 氢氧燃料电池负极消耗1.12L气体时,电路中转移的电子数为0.1NA
D. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为比较酸性条件下ClO—、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略)。
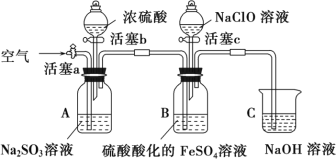
实验步骤及现象记录如下:
Ⅰ.打开活塞c,向装置B滴加次氯酸钠溶液,溶液立即变为黄色,一段时间后观察到装置B中液面上方出现黄绿色气体时,立即关闭活塞 c。
Ⅱ.用注射器取出少量装置B中的溶液,滴加几滴KSCN溶液,溶液变为血红色。
Ⅲ.打开活塞b,向装置A中加入足量浓硫酸后,关闭活塞b,装置A中产生气体,装置B中有气泡,一段时间后,观察到装置B中溶液黄色变浅绿色。
Ⅳ.一段时间后,用注射器取出少量装置 B 中的上层清液。
Ⅴ.打开旋塞a,通一段时间空气。
请回答下列问题:
(1)在添加药品前需进行的操作是__________________________。
(2)步骤Ⅰ中,一段时间后观察到装置B中液面上方出现黄绿色气体的离子方程式为____________。
(3)步骤Ⅲ中,开始一段时间,装置B中溶液的颜色并无明显变化,此段时间,溶液中发生反应的离子方程式为____________。
(4)步骤Ⅳ是为了验证该溶液中存在的Fe2+。请补充完整该步骤合理的操作及实验现象:_______。
(5)步骤Ⅴ的目的为______________。
(6)分析实验现象,可得出该实验的结论是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
III.Sn(OH)2的性质与Al(OH)3性质相似。请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是____________________。
(2)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子方程式是____________________。
(3)滤液I溶质的成分是____________________。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是____________________。
(5)称取SnSO4·x H2O晶体50.2g,在隔绝空气的情况下小火加热至结晶水全部失去,冷却称量固体质量为43g,则该晶体的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH。起始时只充入CH4与H2O(g),设
CO(g)+3H2(g) ΔH。起始时只充入CH4与H2O(g),设![]() =Z,保持反应压强不变,平衡时CH4的体积分数ω(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
=Z,保持反应压强不变,平衡时CH4的体积分数ω(CH4)与Z和T(温度)的关系如图所示,下列说法正确的是
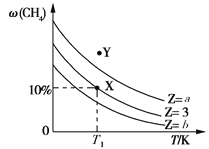
A. a>3>b
B. 保持温度不变,平衡体系加压后ω(CH4)增大
C. 温度为T1、Z=3时,Y点所对应的反应向逆反应方向进行
D. X点时,H2的体积分数为30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学中常用的物理量,请完成以下有关其计算的内容。
(1)0.2 g H2含有___________________个H原子。
(2)标准状况下,含有相同氧原子数的CO与CO2的体积之比为__________。
(3)100 mL 某Al2(SO4)3溶液中,c(Al3+) = 2.0 mol/L,则其中c(SO42-) = _________mol/L。
(4)工业上利用下列反应进行海水中溴元素的富集:Br2 + SO2 + 2H2O = H2SO4 + 2HBr 。若反应中生成了 0.2 mol HBr,则消耗SO2的体积(标准状况)是________________L。
(5)当SO2、SO3的分子个数之比为1:2时,原子总数之比为___________,质量之比为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com